钙是维持人体正常功能所必需的元素,有时需要服用补钙剂满足人体需求。下图分别为两种补钙剂说明书的一部分。
请根据图示中的信息回答下列问题:
(1)钙是人体必须的常量元素,每日要摄取足够量的钙,才能避免 (填字母序号)。
A.佝偻病或骨质疏松症
B.贫血症
C.甲状腺肿大
(2)葡萄糖酸钙中钙元素的质量分数为 (计算结果精确到0.1%)。
(3)每片金钙尔奇中含碳酸钙的质量为 mg。
(4)按照葡萄糖酸钙说明书每日的补钙量,若改用金钙尔奇,一日2次,一次应服用 片。
取50g碳酸钠和氯化钠的混合溶液。向其中逐滴加入稀盐酸。加入稀盐酸的质量和生成气体的质量见下表(气体的溶解度忽略不计)。
|
第一组 |
第二组 |
第三组 |
|
|
稀盐酸的质量/g |
20 |
40 |
60 |
|
生成气体的质量/g |
2.0 |
m |
5.5 |
另取该混合溶液50g加入上述浓度的稀盐酸至恰好完全反应,此时溶液的pH=7,然后再加入足量的硝酸银溶液得到白色沉淀57.4g。试分析计算:
(1)50g混合溶液中碳酸钠的质量为 g。
(2)50g混合溶液中氯化钠的质量分数是多少?(写出计算过程,计算结果精确至0.1%)
在实验室中,某同学发现了一瓶敞口放置的氢氧化钙粉末试剂,并对其产生兴趣,进行如下实验。

根据实验过程和图象提供的信息,回答下列问题:
(1)完全反应后生成气体的质量是 g。
(2)b点溶液中的溶质为 (填名称)。
(3)求恰好完全反应时所得溶液中溶质的质量分数?(利用化学方程式进行计算,书写计算过程,结果精确到0.1%)
某化学兴趣小组同学在清理实验室时发现一瓶浓盐酸,标签如下.
根据标签计算.
(1)HCl中氢元素和氯元素的质量比为 (结果用最简整数比表示).
(2)这瓶盐酸溶液的质量为 g.
(3)现要配制3800g溶质质量分数为10%的稀盐酸,需要溶质质量分数为38%的浓盐酸的质量为 g,需要这种浓盐酸 瓶.

炒菜时加入料酒和食醋,炒出的菜才别具香味,其原因之一是料酒中的乙醇与食醋中的乙酸反应生成乙酸乙酯(C 4H 8O 2),试计算:
(1)乙酸乙酯的相对分子质量为 ;
(2)乙酸乙酯中碳、氢元素的质量比为 ;(最简整数比)
(3)17.6g乙酸乙酯中所含氧元素的质量为 g。
取100g溶质的质量分数为5.3%的Na 2CO 3溶液,然后按如图进行实验.
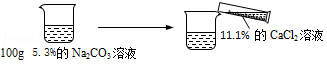
(1)恰好完全反应时产生沉淀质量是 g;
(2)恰好完全反应后将烧杯内的物质过滤.计算所得滤液中溶质的质量分数(计算结果保留至0.1%).