同学们做甲、乙两个中和反应实验的探究,如图所示: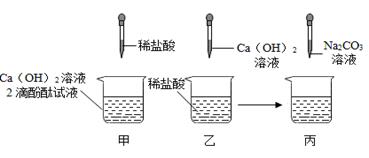
(1)甲实验恰好中和,则该溶液中的溶质是_____ (填化学式)。
(2)取乙反应后的溶液60.0g,滴加质量分数26.5%的Na2CO3溶液,如图丙,溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为_____g;请计算该溶液中CaCl2的溶质质量分数(写出计算过程,精确到0.1%)。
(3)根据计算所得数据在图戊中画出产生沉淀的曲线。
某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数。小刚进行了如图实验。请计算:
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数。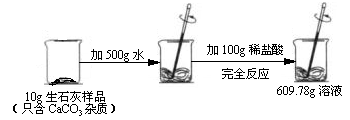
黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中铜的质量分数,现取10 g该样品粉碎,加入到50 g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5 g。计算:
(1)黄铜样品中铜的质量分数。
(2)稀硫酸中溶质的质量分数。
(3)由此得到启示是:在使用黄铜制品时应注意。(合理即可)
某钢铁厂每天消耗4 000 t含Fe2O3 80%的赤铁矿石,该钢铁厂理论上可日产含Fe 98%的生铁质量是多少?(计算结果保留到0.1)
金属镁可用于火箭、飞机、轮船的制造。镁在现代材料工业中需求量逐渐增大。海水中含有约0.129%的镁元素,仅次于氯化钠,总储量约1 800亿吨,开发潜力很大。
(1)在提取镁的生产过程中,需要浓缩海水,提高海水中氯化镁的质量分数,你认为既环保又经济的方法是;
(2)浓缩海水中MgCl2的质量分数为9.5%,求要将150吨浓缩海水中MgCl2都转化为Mg(OH)2,理论上需要Ca(OH)2多少吨?
根据如图所示信息计算:
(1)加入的稀硫酸质量为g。
(2)所用稀硫酸溶质的质量分数。(化学方程式:2KOH+H2SO4=K2SO4+2H2O)