药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得(已知在中学阶段羧基、酯基、酰胺基(-CONH-)不与氢气发生加成反应,给特殊信息除外,下同):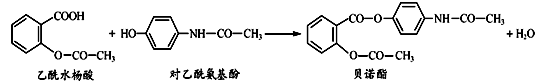
下列有关叙述正确的是
| A.贝诺酯分子可与6molH2完全反应 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
| D.乙酰水杨酸和对乙酰氨基酚均可与NaHCO3溶液反应 |
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI═I2+2KCl
②2FeCl3+2HI═I2+2FeCl2+2HCl
③2FeCl2+Cl2═2FeCl3
④I2+SO2+2H2O═2HI+H2SO4.
| A.Cl2>I2>Fe3+>SO2 |
| B.Fe3+>Cl2>I2>SO2 |
| C.Cl2>Fe3+>I2>SO2 |
| D.Cl2>Fe3+>SO2>I2 |
实验室制取少量N2常利用的反应是NaNO2+NH4Cl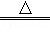 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
| A.NaNO2是氧化剂 |
| B.生成1molN2时转移的电子为6mol |
| C.NH4Cl中的N元素被还原 |
| D.N2既是氧化剂又是还原剂 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4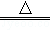 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是
| A.KClO3在反应中得到电子 |
| B.H2SO4是该反应的氧化剂 |
| C.H2C2O4在反应中被还原 |
| D.1 mol KClO3参加反应,有2mol电子转移 |
在无色、碱性溶液中能大量共存的一组离子是
| A.Ca2+、Na+、SO42﹣、HCO3﹣ |
| B.K+、Fe2+、SO42﹣、MnO4﹣ |
| C.Ba2+、K+、Al3+、Cl﹣ |
| D.Na+、Ba2+、Cl﹣、NO3﹣ |
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
| A.青菜中含有维生素C |
| B.维生素C具有还原性 |
| C.致人中毒过程中砷发生还原反应 |
| D.砒霜是氧化产物 |