空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者 后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是 (填字母编号)。
| A.Na2CO3 |
| B.NaHCO3 |
| C.NaAlO2 |
| D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
300 |
500 |
700 |
| K |
3.00 |
3.47 |
4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为 。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:
①催化剂b表面的电极反应式为 。
②经测定,若每分钟通过质子交换膜的H+的物质
的量为40mol,则每小时可产生O2 Kg。
氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化形式主要是______,在导线中电子流动方向为______(用a、b表示)。
(2)负极反应式为__________________。
有如下两个反应
A:2HCl+Ba(OH)2=BaCl2+2H2OB:2Fe3++Cu=2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A,B,(填“能”或“不能”)不能设计成原电池的原因是;
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是,正极材料是,电解质溶液是;
②写出负极的电极反应式;
③若导线上转移电子0.2 mol,则负极质量减少。
有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图。
(2)A、E氢化物的稳定性比较。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序(用离子符号表示)。
(4)用电子式表示C与D形成化合物的形成过程:
。
(5)写出D单质与B的最高价氧化物对应水化物反应的离子方程式:
。
(6)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子方程式:
。
下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
(1)在上表所列出的短周期元素中(填具体物质化学式)原子半径最小的是(除稀有气体元素);阴离子还原性最弱的是;
最高价氧化物对应的水化物中酸性最强的是。
(2)F和G两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是。(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(3)Q在元素周期表中的位置是,B元素形成的单质的结构式为。
(4)写出E的最高价氧化物对应的水化物与G单质发生的反应的离子方程式:
。
某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。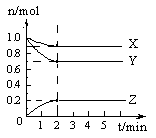
(1)反应开始至2 min,Y的平均反应速率为;
(2)分析有关数据,写出X、Y、Z的反应方程式:
;
(3)反应达到最大限度时,Y的转化率为。