在密闭容器中通入NO和CO各2mol发生反应:
2NO(g) + 2CO(g)  2CO2(g) + N2(g)
2CO2(g) + N2(g)
容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如下图所示。
以下说法合理的是
| A.温度T2>T1 |
| B.压强P2>P1 |
| C.II曲线表示NO平衡转化率为25% |
| D.该反应的焓变△H<0 |
在无色透明的溶液中可以大量共存的离子组是()
| A.OH- K+ Al3+ | B.OH- NH4+ Cl- |
| C.Cu2+ NO3- Cl- | D.Mg2+ K+ Cl- |
欲配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是()
| A.100mL容量瓶 | B.分液漏斗 | C.玻璃棒 | D.烧杯 |
下列实验操作或装置正确的是()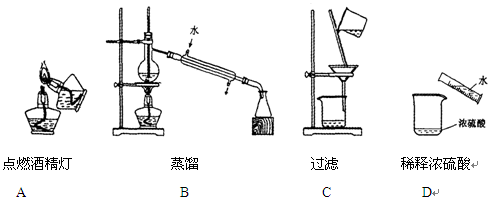
下列反应属于氧化还原反应的是()
A.H2SO4+2NaOH  Na2SO4+2H2O Na2SO4+2H2O |
B.2NaHCO3  Na2CO3 + CO2↑ + H2O Na2CO3 + CO2↑ + H2O |
C.NH3 + HCl  NH4Cl NH4Cl |
D.CuO + H2 Cu + H2O Cu + H2O |
下列分散系中分散质的微粒直径与纳米粒子具有相同数量级的是()
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |