连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?______________________________(填一注意事项)。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示: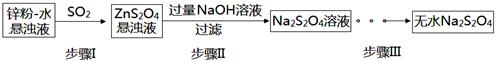
①步骤I中SO2表现了____________(填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________.
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3===____Na2S2O4↓+___H2O+_________
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。___________________ _________.
已知难溶于水的盐在水中存在溶解平衡: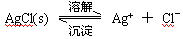
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP= c(Ag+)·c(Cl-)=1.8·10-10。
若把足量AgCl分别放入① 100 mL蒸馏水,② 100 mL 0.1 mol / L NaCl溶液,③ 100 mL 0.1 mol / L AlCl3溶液,④ 100 mL 0.1 mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______>______>______>______。在0.1 mol / L AlCl3溶液中,Ag+的物质的量浓度最多为_________mol / L。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则(填“甲”或“乙”)判断正确。试剂X是。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH(填“高于”、“低于”或“等于”)8.3,则(填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言(填“甲”或“乙”)判断是错误的,理由是。
用标准酸液滴定待测碱液时,下列操作对所测碱液的物质的量浓度有何影响。
A、偏低 B、偏高 C、无影响
请用序号填空
(1)用待测液润洗锥形瓶后再注入所量取的一定体积待测液____________
(2)未用标准液润洗酸式滴定管就直接注入标准酸液_________________
(3)用滴定管尖端未排气泡的碱式滴定管量取待测碱液_________________
(4)滴定前仰视读数、滴定后俯视读数_______________________________
(5)锥形瓶未润洗,且瓶中有少量蒸馏水_____________________________
化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O  NH3·H2O
NH3·H2O  NH
NH +OH-
+OH-
(1)向氨水中加入MgCl2固体时,平衡向______移动,OH-的浓度_____,NH4+的浓度_______。
(2)向氨水中加入浓盐酸,平衡向______移动;
(3)向浓氨水中加入少量NaOH固体,平衡向_____移动,此时发生的现象是__________。
将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)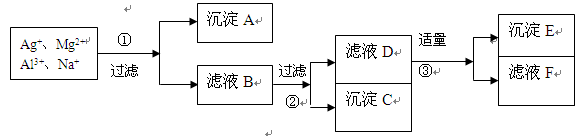
(1)沉淀A是 ___,沉淀C ___,沉淀E是;
(2)加入试剂①是 ____,②是________________,③是______________。