(【化学—物质结构与性质】1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)Mn和Fe的部分电离能数据如表:
| 元 素 |
Mn |
Fe |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。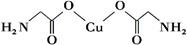
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| |
分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式 (标出配位键);深蓝色晶体中不存在的微粒间作用力有 。
A.范德华力
B.离子键
C.共价键
D.金属键
E.配位键
金属铜不溶于稀硫酸,但可溶于铁盐溶液。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)。
(1)写出铜溶解于上述混合溶液的离子方程式_______________________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是_________g,溶液中的c(SO42—)=__________mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,则:X极是(正、负极),电极反应式。Y极的材料是,电极反应式。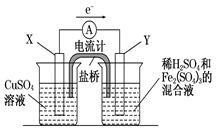
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) 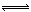 CH3OH(g)。
CH3OH(g)。
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=;H2的平衡转化率为_________________________。
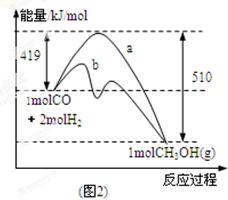
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式。
(3)该温度下,反应平衡常数K=______________(填数值),温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)。
(4)恒容条件下,下列措施中能使反应体系中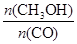 增大的措施有。
增大的措施有。
a.升高温度 b.充入He气 c.再充入2 molH2 d.使用催化剂
化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。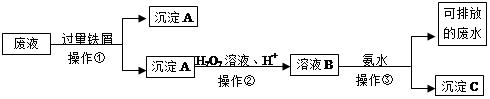
(1)操作①的名称是。
(2)沉淀A中含有的金属单质有。
(3)操作②中在酸性下发生反应的离子方程式。
(4)检验溶液B中含有的金属阳离子常用的试剂是。
(5)操作③中发生反应的离子方程式为。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:_________。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种,它是一个巨大的宝藏。
①海水中镁的总储量约为1.8×1015 t,海水里镁的存在形式主要是。(填“游离态”或“化合态”)
②下列物质不经过化学变化就能从海水中获得的是。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①工业上制造光导纤维的基本原料是。
②下列物质中,不能用来制造耐火材料的是。(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
(3)保持洁净安全的生存环境已成为全人类的共识。
①pH<的雨水称为酸雨。
②下列物质中,会破坏臭氧层的是。(填字母)
A.氮气 B.一氧化碳 C.氟氯烃