某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示。下列说法正确的是
| A.电池工作时Na+从b极区移向a极区 |
| B.b极上的电极反应式为:H2O2+2e-+2H+=2H2O |
| C.每消耗3molH2O2,转移3mole- |
| D.a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O |
已知1~18号元素的离子aX m+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确的是
| A.若P>K,则还原性cZP- <dWk- |
| B.若m > n, 则碱性 X(OH)m > Y(OH)n |
| C.若半径aX m+>bY n+ ,则a<b |
| D.若半径aX m+ > bY n+ ,则X的单质一定能从含Y n+ 的盐溶液中置换出Y |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是( )
| A.当V(NaOH)="20" mL时,溶液中离子浓度大小关系: c(Na+) >c(HA一)>c(H+)> c(A2- )>c(OH—) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸或碱 |
| D.向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
pH=11的x、y两种碱溶液各5 mL,分别稀释至500 mL,其pH与溶液体积(V)的关系
如图所示,下列说法正确的是()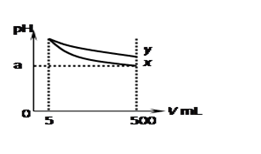
| A.若x、y都是弱碱,则a的值一定小于9 |
| B.稀释后x溶液中水的电离程度比y溶液中水电离程度小 |
| C.完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
| D.若x、y是一元碱,则等物质的量浓度的y的硝酸盐溶液的pH比x的硝酸盐溶液小 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO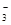 、SO 、SO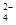 、Na+ 、Na+ |
B.无色溶液中:K+、Fe3+、SO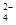 、SCN- 、SCN- |
C. =1012的溶液中:NH =1012的溶液中:NH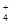 、Al3+、NO 、Al3+、NO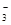 、Cl- 、Cl- |
D.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO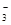 |
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是( )
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是( )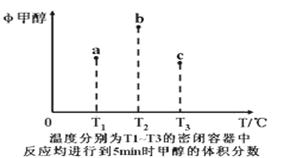
| A.该反应的正反应的△H>0 |
| B.反应进行到5min时,a容器中v正=v逆 |
| C.减压可将b中的平衡状态转变成c中的平衡状态 |
| D.达到平衡时,a、b、c中CO的转化率为b>a>c |