下列说法正确的是
| A.一定温度下,10mL 0.50mol·L-1 NH4Cl溶液与20mL 0.25mol·L-1 NH4C1溶液含NH4+物质的量相同 |
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3·H2O的电离常数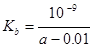 |
C.一定温度下,已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO- +H+,加少量烧碱溶液可使溶液中 CH3COO- +H+,加少量烧碱溶液可使溶液中 值增大。 值增大。 |
| D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
 下列反应: ①金属钠与水反应②过氧化钠和水反应③二氧化氮和水反应④氯气和水反应⑤三氧化硫和水反应,其中属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是
下列反应: ①金属钠与水反应②过氧化钠和水反应③二氧化氮和水反应④氯气和水反应⑤三氧化硫和水反应,其中属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是
| A.全部 | B.②③④⑤ | C.只有②③④ | D.只有③④ |
下列现象或事实可用同一原理解释的是
| A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| B.氯水和活性炭使红墨水褪色 |
| C.漂白粉和钠长期暴露在空气中变质 |
| D.氯水和过氧化钠使品红褪色 |
下列表述正确的是
A.次氯酸的电子式 |
B.H2O与D2O互为同位素 |
| C.乙醇与二甲醚互为同分异构体 | D.CO2、CO、C互为同素异形体 |
以下各分子中,所有原子都满足最外层为8电子结构的是
| A.H3O+ | B.BF3 | C.P4 | D.PCl5 |
下列有关物质制备的说法中正确的是
| A.工业上通过电解MgO制取镁 |
| B.工业上通过向浓缩的海水中通入氯气获得碘 |
| C.工业上主要通过高温冶炼黄铜矿获得铜 |
| D.工业上用二氧化锰与浓盐酸制备氯气 |