某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O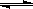 NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是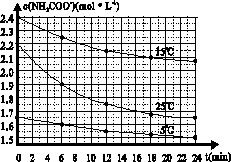
| A.0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B.c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C.25 ℃时0~6 min,v(NH2COO-)为0. 05 mol·L-1·min-1 |
| D.15 ℃时,第30 min时,c(NH2COO-)为2.0 mol·L-1 |
用加热方法可分离的一组是()
| A.氯化铵和消石灰 | B.碳铵和过氧化钠 |
| C.碘和食盐 | D.氯化铵和氯化钡 |
在一定体积的容器中,加入1.5mol氙气和7.5mol氟气,于400℃和2663kPa压强下,加热数小时,然后迅速冷却到25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数比是……( )
| A.1:2 | B.1:3 | C.1:4 | D.1:6 |
在无土栽培中,需配制一定量含50molNH4Cl、16molKCl和24molK2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)……( )
| A.2、64、24 | B.64、2、24 | C.32、50、12 | D.16、50、24 |
同温同压下,两个容积相等的贮气瓶,一个装C2H6,另一个装C2H2和C2H6的混合气体,两瓶内的气体一定具有相同的……( )
| A.质量 | B.原子总数 | C.碳原子数 | D.密度 |
某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g。若向此溶液中加3.5g氯化钠和6.5g水,则所得溶液的溶质质量分数是……( )
| A.30% | B.(26.5+3.5)/(100+6.5) ×100% | C.26.5% | D.(26.5+3.5)/(100+6.5+3.5) ×100% |