高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是 。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在 (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的电极反应式是 。
(2)某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下: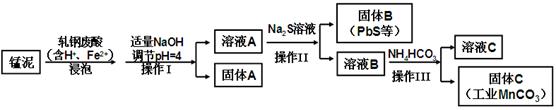
③轧钢废酸中Fe2+的作用是 。
④操作I、操作Ⅱ、操作Ⅲ的名称是 。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是 。
⑥若固体C中不含CaCO3,则溶液C中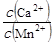 < (已知:Ksp(MnCO3)=1×10-11,Ksp(CaCO3)=5×10-9)。
< (已知:Ksp(MnCO3)=1×10-11,Ksp(CaCO3)=5×10-9)。
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
(8分)某白色粉末A常在果园里用作杀菌剂,现进行下列实验:①白色粉末溶解在水中,得到蓝色溶液;②往蓝色溶液中加入适量的盐溶液B,恰好沉淀完全,过滤,得到白色沉淀和蓝色溶液;③往蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硝酸钾溶液。
(1)根据实验现象推断 A.,B.,C.。
(2)写出操作②所发生反应的化学方程式:。
氧化还原反应在农业生产中和日常生活中有广泛的运用。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6),提供能量以维持生命活动,反应的化学方程式为C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有(填“氧化性”或“还原性”)
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中,维生素C所起的作用是填“氧化作用”和“还原作用”)
(4)全世界每年有近1/10的钢铁因生锈而损失,人们常用稀硫酸除去钢铁表面的铁锈(Fe2O3),请写出除铁锈的离子方程式:,然而这并不能解决根本问题,实质上我们应该怎样防止铁生锈,生活中通常采用方法(符合题意一种即可)防止铁生锈。
现有mg某气体,它由四原子分子构成,它的摩尔质量为Mg·mol-1。则:
(1)该气体的物质的量为__________________mol;
(2)该气体所含原子总数为________________个(用NA表示即可);
(3)该气体在标准状况下的体积为_____________L;
(4)该气体溶于水后形成 V L溶液,其溶液的物质的量浓度为____________ mol·L-1;
(5)该气体溶于a ml 水中(假设该气体与水不反应),所得溶液溶质质量分数为_______。
(12分
下图是元素周期表的一部分:
⑴表中区域名称s、p……等确定的依据是_______________________________________。
⑵已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布式为______________,B在元素周期表中的位置是___________。
⑶上表中元素x的一种氢化物的晶体结构如图所示,写出该化合物在氯气中燃烧的化学方程式。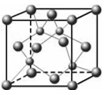
除x外,第四周期中最外层只有一个电子的还有(填元素名称)。
⑷表中短周期非金属元素之间可以形成形形色色的有机物,如邻羟基苯甲醛(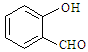 )和对羟基苯甲醛(
)和对羟基苯甲醛(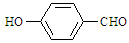 ),前者沸点低于后者,理由是
),前者沸点低于后者,理由是
_____。