聚乙酸乙烯酯广泛用于制备涂料、粘合剂等,它和高聚物K的合成路线如下: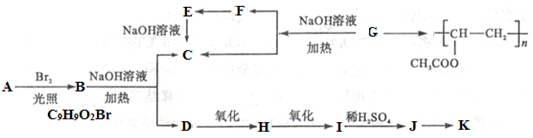
其中J物质与氯化铁溶液能发生显色反应,且苯环上的一元取代物只有两种。
已知:①当羟基与双键碳原子相连时,易发生如下转化RCH =CHOH→RCH2CHO
②—ONa连在烃基上不会被氧化
请回答下列问题:
(1)写出G的结构简式_______________。F与H中具有的相同官能团名称为__________。
(2)上述变化中G→C+F 的反应类型是__________________;J在一定条件下能生成高聚物K,K的结构简式是________________________。
(3)写出B→C+D反应的化学方程式________________________________________。
(4)同时符合下列要求的A的同分异构体有_____________种。
I、含有苯环;
II、能发生银镜反应和水解反应;
在这些同分异构体中,满足下列条件的同分异构体的结构简式为______________________。
①核磁共振氢谱有5个吸收峰 ;
②1mol该同分异构体能与1mol NaOH 反应
(5)下列有关说法正确的是___________________。
a.1 mol A 完全燃烧消耗10.5 mol O2
b.J与足量的碳酸氢钠溶液反应能生成相应的二钠盐
c.D→H 的试剂通常是KMnO4酸性溶液
d.J能发生加成、消去、取代、氧化等反应
聚乳酸是一种新型可生物降解的高分子材料,乳酸[ ]在催化剂作用下聚合成聚乳酸,聚乳酸材料废弃后,先水解成乳酸,乳酸在空气中微生物的作用下被氧化为CO2和H2O。
]在催化剂作用下聚合成聚乳酸,聚乳酸材料废弃后,先水解成乳酸,乳酸在空气中微生物的作用下被氧化为CO2和H2O。
(1)用化学方程式表示:乳酸合成聚乳酸的反应 。乳酸在空气中微生物作用下降解的反应 。
(2)如果以丙烯(CH2=CH-CH3)为主要原料(其它无机原料任选)合成乳酸,其合成过程的流程图加下:
①的反应类型: ②的反应条件: 、加热
A的结构简式: B中含有的官能团的名称是
(3)乳酸在一定条件下可以发生消去反应生成丙烯酸,方程式为 。
芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1mol H2,若1 mol C与NaHCO3完全反应,也产生1 mol气体,E可以使溴的四氯化碳溶液褪色。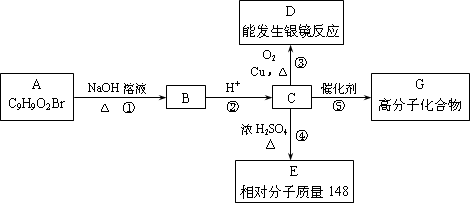
(1)A的结构简式是 。
(2)反应①的化学方程式是 。
反应④的化学方程式是
(3)写出由E生成高分子化合物反应的化学方程式 。
(4)现有C和E的混合物n mol,在空气中完全燃烧消耗O2 L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为: 。
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2= CH2+HOCl→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如下图所示。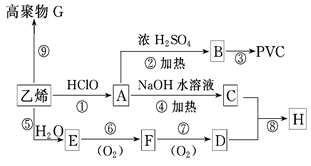
试回答下列问题:
(1)A中官能团的名称是 ,G的结构简式是 。
(2)写出D的同分异构体的结构简式: , 。
(3)写出反应⑥的化学方程式:______________________________________。
(4)写出C与D按物质的量之比为1∶2反应生成H的化学方程式 ____________。
(15分)香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):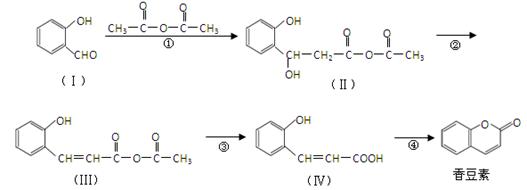
(1)Ⅰ的分子式为 ;
(2)反应②的反应类型是 ,反应④的反应类型是 。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为 。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为 (任写一种)。
(5)一定条件下,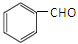 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。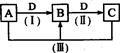
请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分写出反应(Ⅲ)的化学方程式:
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一种金属元素的无机化合物,反应(Ⅲ)的离子方程式为
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(Ⅲ)中氧化产物与还原产物的物质的量之比为。0.1 mol A与含O.15 mol NaOH的溶液充分反应后,溶液中所含离子浓度的大小关系为。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为 ,D的电子式为。
②25℃时,浓度均为O.1 mol/l的B、C溶液,pH较大的是(填溶质的化学式)溶液,写出B 溶液中显电中性的原因:。已知,B溶液的PH=a,则其水电离出来的H+的浓度为: