锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下: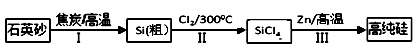
(1)1mol焦炭在过程Ⅰ中失去 mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为 。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为 。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s) Si(S)+2ZnCl2(g) △H<0下列说法正确的是( )
Si(S)+2ZnCl2(g) △H<0下列说法正确的是( )
| A.还原过程需在无氧的气氛中进行 |
| B.投入1molZn可生成14g还原产物 |
| C.增加SiCl4(g)的量,该反应平衡常数不变 |
| D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp= (两位有效数字)。
从一个关系量的单位,我们可以得出该量的计算公式,如:从摩尔质量的单位:g·mol-1,可得出分子应当是质量、分母应当是物质的量,因此摩尔质量的计算公式为 M = m / n,以此类推,物质的量浓度单位是,其计算公式c = ;
由微粒个数与物质的量的关系推出阿佛加德罗常数的公式NA= ;
气体摩尔体积的单位是,其计算公式是Vm= 。
0.1mol H2S共有约mol电子,17g NH3共有个电子。同温同压下,同体积的NH3和H2S气体气体的质量之比为;同温同压下,同质量的NH3和H2S气体的体积比为;氢原子的个数比为
在mol Al2(SO4)3中含0.3molSO42-,其中含Al3+mol。在2L的0.5mol/LNa2SO4溶液中含有molNa+,molSO42-,c(Na+)为mol/L,其中Na2SO4的质量为g。
二氧化碳的摩尔质量是,9g水的物质的量是,0.5mol O2在标准状况下的体积约为。
化合物C是一种合成药品的中间体,其合成路线为: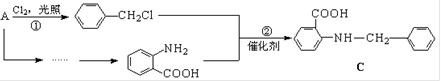
已知: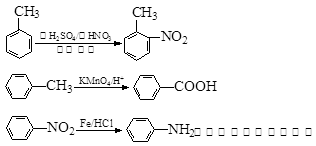
(1)写出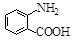 中官能团的名称。
中官能团的名称。
(2)写出反应①的化学方程式。
(3)写出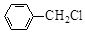 含苯环的同分异构体的结构简式。
含苯环的同分异构体的结构简式。
(4)以下是由A经过四步反应合成B的路线: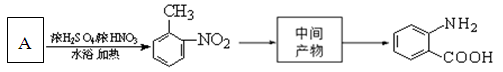
请写出中间产物的结构简式:。
(5)请设计一个实验,证明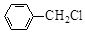 分子中含有氯原子,按实验操作顺序,依次需要加入的试剂是_______________、_______________、________________。
分子中含有氯原子,按实验操作顺序,依次需要加入的试剂是_______________、_______________、________________。