某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0. 1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加人过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
IV、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
下列推断不正确的是:
| A.由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ |
| B.Ⅲ中加人盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O |
| C.原溶液一定只含有的离子I-、NO3-,SO42-,Mg2+、Al3+ |
| D.另取1OOmL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4 g |
可逆反应:3 A(气) 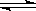 3 B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量变小,则下列判断正确的是
3 B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量变小,则下列判断正确的是
| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C可能都是液体 |
一定温度下反应:A2(g)+3 B2(g)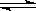 2 AB3(g)(每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
2 AB3(g)(每生成2 mol AB3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol A2和3 mol B2,达平衡时放出热量为Q1,②通入2 mol A2和6 mol B2,达平衡时放出热量为Q2,则下列关系正确的是
| A.Q2 =" 2" Q1 | B.2Q1 < Q2 |
| C.Q1 < Q2 < 92.4 kJ | D.Q1 = Q2 < 92.4 kJ |
下列说法正确的是
(1)增加水的量或升高温度,一定可以加快镁跟水的反应速率
(2)增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
(3)对于反应CaCO3(s) 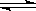 CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
CaO(s) + CO2(g),增加CaCO3的量,可以加快正反应速率,而增加CaO或CO2的浓度,则可以加快逆反应速率
(4)对于反应3H2(g) + N2(g)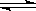 2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
2NH3(g),在密闭容器中进行(固定体积),现充入氦气,由于容器中压强增大,则化学反应速率加快
(5)对于反应3H2(g) + N2(g) 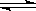 2NH3(g),使用适合催化剂,正逆反应速率同等程度加快
2NH3(g),使用适合催化剂,正逆反应速率同等程度加快
| A.(1)(2) | B.(1)(2)(3) |
| C.(1)(2)(3)(4) | D.(5) |
仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是
| A.加热 | B.加压 | C.降温 | D.增大反应物浓度 |
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ·mol—1 |
| B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2b kJ·mol—1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4b kJ·mol—1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=b kJ·mol—1 |