设 为阿伏伽德罗常数的值,下列叙述正确的是
为阿伏伽德罗常数的值,下列叙述正确的是
A.常温下, 的 的 溶液中氮原子数为0.2 溶液中氮原子数为0.2 |
| B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA |
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3  转移的电子数为6 转移的电子数为6 |
| D.标准状况下,22.4 L的CCl4中C—Cl键数为4NA |
设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=a kJ/mol
2C(s)+O2(g)=2CO(g)△H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是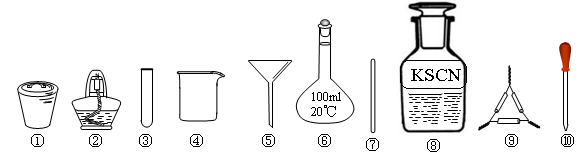
| A.将茶叶灼烧灰化,选用①、②和⑨ |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到滤液,选用④、⑤和⑦ |
| D.检验中滤液中的Fe3+,选用③、⑧和⑩ |
下列实验操作与预期的实验目的或结论均正确的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
向FeCl3溶液中通入Cl2,然后滴加KSCN溶液 |
验证Cl2的氧化性比Fe3+强 |
| B |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中不一定含有SO42- |
| C |
用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色 |
该溶液中一定含有Na+,一定无K+ |
| D |
直接加热MgCl2·6H2O晶体 |
获取无水MgCl2固体 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5 MnO2+2 Ag+2 NaCl=Na2Mn5O10+2 AgCl。下列关于“水”电池的说法不正确的是
| A.AgCl是还原产物 |
| B.负极的电极反应为:Ag+Cl- — e-=AgCl |
| C.Na+不断向“水”电池的正极移动 |
| D.每生成1mol Na2Mn5O10转移2mol电子 |