对于Zn与稀硫酸的反应,下列叙述不正确的是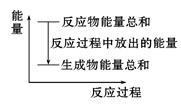
| A.反应过程中能量关系可用如图表示 |
| B.若将该反应设计成原电池,锌为负极 |
| C.若将该反应设计成原电池,正极可用石墨 |
| D.若将其设计为原电池,当有32.5 g锌溶解时,正极放出的气体一定为11.2 L |
用下图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验
不合理的是 
| A.③中选用NaOH溶液吸收多余的SO2 |
| B.上下移动①中铜丝可控制SO2的量 |
| C.②中选用品红溶液验证SO2的生成 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
关于硝酸的说法正确的是
| A.硝酸与金属反应时,主要是+5价的氮得电子 |
| B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水 |
| C.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
将SO2气体通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体仍无沉淀产生。则通入的该气体可能是
| A.NO2 | B.NH3 | C.CO2 | D.Cl2 |
同一周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的化学式分别为H2XO3、H3YO4、H2ZO4,下列说法正确的是
| A.气态氢化物的稳定性:XH4>YH3>H2Z; |
| B.元素非金属性强弱关系:X>Y>Z |
| C.最高价氧化物对应水化物酸性:H2XO3>H3YO4>H2ZO4 |
| D.原子半径:X>Y>Z |
下列说法中肯定错误的是
| A.某原子K层上只有一个电子 |
| B.某原子M层上电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某原子的核电荷数与最外层电子数相等 |