Ⅰ.甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51 kJ,则表示甲醇燃烧热的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2=
O2(g)= CO2(g)+2H2(g) △H2=
已知H2(g)+ O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2= 。
O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2= 。
(3)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)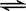 CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
Ⅱ.元素铬及其化合物工业用途广泛。但含+6价铬的污水会损坏环境。电镀厂产生的镀铜废水中含有一定量的Cr2O72-,处理该废水常用还原沉淀法。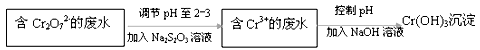
(1)下列溶液中可代替上述流程中Na2S2O3溶液的是 (填选项序号)
| A.FeSO4溶液 | B.浓H2SO4 | C.酸性KMnO4 | D.Na2SO3溶液 |
(2)上述流程中,每消耗1mol Na2S2O3,转移0.8mol电子。则加入Na2S2O3溶液时发生反应的离子方程式为: 。
(3)Cr(OH)3的化学性质与AlOH)3相似,在述流程中加入NaOH溶液时,需控制溶液的pH不能过高,用离子方程式表示其原因: 。
①碱金属元素原子最外层电子数都是_________个,在化学反应中它们容易失去_______个电子,碱金属元素原子半径最小的元素是_____________(填元素符号)。
②卤素原子最外层的电子数都是______________,在化学反应中它们容易得到___________个电子,在卤族元素中非金属性最强的是_______________(填元素符号)。
Ⅰ、你见过翩翩起舞的鸡蛋吗?请看以下小实验。(已知白醋浓度比普通食醋浓度大)
甲组:一个鸡蛋、一瓶普通食醋、一个玻璃杯。
乙组:一个鸡蛋、一瓶白醋、一个玻璃杯。
操作:(1)将醋倒入玻璃杯内。(2)把鸡蛋放入杯中。(3)仔细观察,刚开始时鸡蛋沉在水底,可是过了一会儿,鸡蛋周围会出现许多小气泡,这些气泡伴着鸡蛋旋转上升,好像鸡蛋在“跳舞”一样。乙乙组鸡蛋“舞”的比甲组的要剧烈一些。同学们根据以上现象提出了推测:醋酸的浓度越大,鸡蛋“舞”的就越剧烈。于是就换用了冰醋酸(纯净的醋酸)。结果鸡蛋在其中却一点也没有“舞”起来。请回答:
(1)写出鸡蛋周围会出现许多小气泡发生的有关离子方程式
(2)为什么换用了冰醋酸,鸡蛋却一点也没有“舞”起来?
Ⅱ、可用于分离或者提纯物质的方法有:
| A.升华 | B.加热分解 | C.洗气 | D.过滤 |
下列各组混合物的分离或提纯应选用上述哪种方法最合适?(填序号)
(3)除去Ca(OH)2溶液中悬浮的CaCO3颗粒,用 。
(4)除去O2中少量的水蒸气,用 。
(5)除去固体碘中混有的少量NaI,用 。
(6)除去KCl中的KClO3,用 。
现有下列10种物质,请按要求回答问题:(一律用序号填写)①镁 ②空气 ③碳酸氢钠 ④氧化钙 ⑤碘酒 ⑥CO2 ⑦酒精 ⑧CuSO4.5H2O ⑨氢氧化铜 ⑩硫酸 其中属于酸的是 ;属于碱的是 ;属于盐的是 ;属于氧化物的是 ;属于有机物的是 ;属于混合物的是 ;属于电解质的是 ;属于非电解质的是 。
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。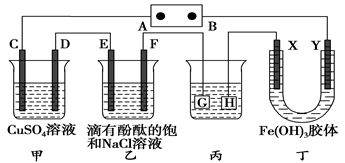
请回答:
(1)B极是电源的________,一段时间后,甲中溶液颜色________________。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为______________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是__ _。
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。
(1)该电池反应的离子方程式为__________________________。
(2)甲醇在__________极发生反应(填“正”或“负”),电池中放电过程中溶液pH将_________(填“下降”、“上升”或“不变”);若有16克甲醇蒸气被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液,假设能量利用率为80%,则将产生标准状况下氧气__________L。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式为_____________________。
(4)放电时固体电解质里的O2-离子的移动方向是向________极移动(填“正”或“负”)。