甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: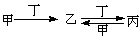
下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为SO2,则丁可能是NaOH溶液 |
| C.若甲为Fe,则丁可能是盐 |
| D.若甲为NaOH溶液,则丁可能是CO2 |
(10分)皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Al3+ |
Cu2+ |
Mg2+ |
Cr3+ |
| 开始沉淀时的pH |
1.9 |
3.7 |
4.7 |
6.7 |
--- |
| 沉淀完全时的pH |
3.2 |
8.0 |
6.7 |
9.3 |
9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是(任写一条)。
(2)调节pH所用X可以选用。
A.NaOHB.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为。
(4)调滤液至pH=8,则滤液中将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)
常温下,0.2 mo1•L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是
| A.HA为弱酸 |
| B.该混合液pH>7 |
| C.图中X表示HA,Y表示OH一,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
某些电子手表安装的纽扣电池由锌和氧化银、KOH溶液构成。放电时,电极反应分别为:
Zn+20H--2e=Zn(OH)2
Ag2O+H20+2e-=2Ag+20H-
下列说法中,正确的是
| A.锌为正极,电极上发生了氧化反应 |
| B.溶液中的OH-向正极移动,K+和H+向负极移动 |
| C.放电过程中,电解质溶液的酸碱性基本保持不变 |
| D.常温下,该电池总反应为非自发的氧化还原反应 |
X、Y均为元素周期表ⅦA族中的两种元素。下列叙述中,能够说明X的原子得电子能力比Y强的是
| A.原子的电子层数:X>Y |
| B.对应的简单离子的还原性:X>Y |
| C.气态氢化物的稳定性:X>Y |
| D.氧化物对应水化物的酸性:X>Y |
下表为某学生进行的两组实验:
| 反应物 |
Na2S2O3溶液 |
H2SO4溶液 |
水 |
||
| 甲 |
0.1 mol•L-1 |
10 mL |
0.1 mol•L-1 |
10 mL |
5 mL |
| 乙 |
0.2 mol•L-1 |
5 mL |
0.2 mol•L-1 |
5 mL |
20 mL |
若其他条件均相同,上述两组实验中,对应反应的反应速率关系为
A.甲>乙 B.甲<乙 C.甲=乙D.无法判断