下列关于元素周期表和元素周期律的说法错误的是
| A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B.第二周期元素从Li到F,非金属性逐渐增强 |
| C.因为Al比Mg失去电子数多,所以Al比Mg的还原性强 |
| D.O与S为同主族元素,且O比S的非金属性强 |
下列说法正确的是()
| A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 |
| B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 |
| C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 |
| D.铜、石墨均导电,所以它们是电解质 |
下列各图曲线分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是 ( )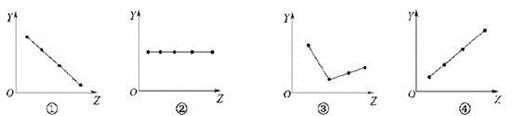
| A.图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系 |
| B.图②可以表示ⅡA族元素的最外层电子数 |
| C.图③可以表示ⅥA族元素氢化物的沸点高低关系 |
| D.图④可以表示第三周期元素的原子半径大小关系 |
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a > b > c > d
B.离子半径:A(n+1)+> Bn+> C(n+1)-> Dn-
C.离子还原性:A(n+1)+> Bn+,离子氧化性:C(n+1)-> Dn-
D单质还原性:B > A,单质氧化性:D > C
下列关于化学键的说法正确的是()
| A.构成单质分子的微粒一定含有共价键 |
| B.全部由非金属元素组成的化合物不一定是共价化合物 |
| C.非极性键只存在于双原子单质分子中 |
| D.不同元素组成的多原子分子里的化学键一定都是极性键 |
下列各组微粒中,半径依次增大的是 ( )
| A.Al3+、Al、Mg、K | B.S、Cl、Cl-、S2- |
| C.Na+、Na、Cl、Cl- | D.Ca2+、K+、S2-、Cl- |