有下列八种晶体:
| A.水晶(SiO2) |
| B.冰醋酸 |
| C.氧化镁 |
| D.白磷 |
E.晶体氩
F.氯化铵
G.铝
H.金刚石。
用序号回答下列问题:
(1)属于原子晶体的化合物是 ,直接由原子构成的分子晶体是 。
(2)含有共价键的离子晶体是 ,只含离子键的是 。
(3)在一定条件下能导电而不发生化学键断裂的是 ,受热熔化后化学键不发生变化的化合物是 ,受热熔化后需克服共价键的是 。
( 10分)分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式
(1)除去MgCl2中混有的少量MgCO3,可选用试剂
(2)除去FeCl3溶液中混有的少量FeCl2 ,可选用试剂
,可选用试剂
(3)除去SiO2中混有的少量CaO,可选用试剂
(4)除去FeCl2溶液中混有的少量Cu2+,可选用试剂
(5 )除去Fe粉中混有的少量铝粉,可选用试剂
)除去Fe粉中混有的少量铝粉,可选用试剂
某芳香烃A有如下转化关系: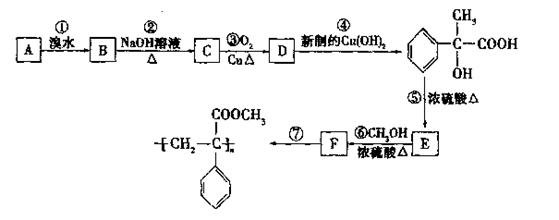
(1)反应②和⑤的类型:②属于反应;⑤属于反应。
(2)A、F的结构筒式A;F。
(3)反应③、⑥的化学方程式:
③;
⑥。
(4)D还可以和新制的银氨溶液反应,化学反应方程式为:。
(5)有机物E有多种同分异构体,请写出与E具有相同官能团的所有同分异构体(不含E):。
某无色溶液X,由K+、Ba2+、Al3+、Fe3+、AlO-2、CO2-3、SO2-4中的若干种离子组成,取该溶液进行如下实验:
(1)气体A是(填化学式,下同),气体B是
(2)写出步骤①中产生气体的离子方程式____
(3)分别写出形成白色沉淀甲、生成气体B的反应的离子方程式。
(4)通过上述实验,可确定X溶液中一定存在的离子是。
尚未确定是否存在的离子是,请设计一个简单的后续实验来确定该离子是否存在,您设计的实验是。
本题含两小题,共14分。
(1)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将Au2O3之外的物质分别填如以下空格内,配平后标出电子转移的方向和数目。
②反应中,被还原的元素是,还原剂是。
③纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,,则还原剂与氧化剂物质的量之比为
。
(2)按要求写出有水参与的氧化还原反应的化学方程式
①水是氧化剂:
②水是还原剂:
③水既不是氧化剂也不是还原剂:
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
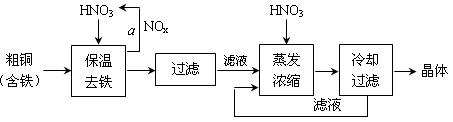
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至 30℃以下,可能析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是;
Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。