(原创)工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出。下列说法错误的是
| A.氧化性:H2SeO4>Cl2;H2SeO3>H2SO4 |
| B.酸性:H2SO4>H2SeO4> H2SeO3 |
| C.析出l mol硒需要消耗标准状况下22.4 L SO2 |
| D.亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |
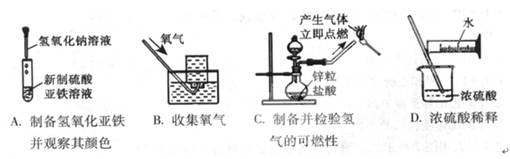
下列实验能达到实验目的且符合安全要求的是
《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是
| A.可用氧化物形式表示为BaO·CuO·2SiO2 | B.x等于6 |
| C.性质稳定,不易脱色 | D.易溶解于强酸和强碱 |
向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
| A.1.14g | B.1.6g | C.2.82g | D.4.36g |
在三氯化铁和氯化铜的混合液中加入过量铁粉,完全反应后,剩余的固体的质量与所加铁粉的质量相等。混合溶液中三氯化铁与氯化铜的物质的量之比为
| A.1:3 | B.2:7 | C.2:3 | D.2:1 |
向50gFeCl3溶液中投入一定量的钠,待反应完毕后,过滤,得到仍有黄色的溶液45.9g,则投入钠的质量
| A.4.6g | B.4.1g | C.6.9g | D.9.2g |