(原创)下列相关的离子方程式书写正确的是
A.NaHS溶液水解: HS-+ H2O  S2- + H3O+ S2- + H3O+ |
| B.向Ca(C1O)2溶液中通入SO2:SO2+2ClO-+H2O=SO32-+2HClO |
| C.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- =BaSO4↓+ NH3·H2O + H2O |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 |
x |
y |
| A |
MgSO4的质量(忽略体积) |
CO的转化率 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
温度 |
容器内混合气体的密度 |
将0.20 mol NO和0.1 mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g) △H<0在不同条件下,反应过程中部分物质的浓度变化如图所示。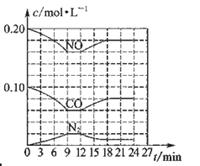
下列说法正确的是
| A.容器内的压强不发生变化说明该反应达到平衡 |
| B.当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C.第12 min时改变的反应条件为减小压强 |
| D.向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
一定条件下存在反应:2SO2(g) +O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是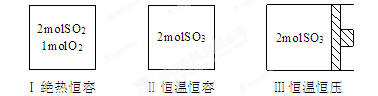
| A.容器I、Ⅲ中平衡常数相同 |
| B.容器II、Ⅲ中正反应速率始终相同 |
| C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III |
| D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和等于1 |
关于25℃时,pH = 12的NaOH溶液,下列说法错误的是
| A.c(OH-) =c(Na+) + c(H+) |
| B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.与等体积pH = 2的醋酸混合后所得溶液显碱性 |
| D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+)> c(NH4+) |
下列关于电解质溶液中离子数目的判断正确的是
| A.0.1L 3.0mol/L的NH4NO3溶液中含有的NH4+的数目为0.3NA |
| B.等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA |
| C.0.1mol/L的NaHSO4溶液中,阳离子的数目之和为0.2NA |
| D.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA |