短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X 与Y、 Z位于相邻周期,X原子内层电子数与Y原子最外层电子数相等,Z原子最外层电子数比X的最外层电子数多2。下列说法正确的是
| A.Y的氧化物是离子化合物 |
| B.X的氢化物溶于水显酸性 |
| C.常温时Z单质的氧化性比X单质的氧化性弱 |
| D.X和 Z的最高价氧化物对应的水化物都是弱酸 |
常温下,用 0.1mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如右图所示。下列说法正确的是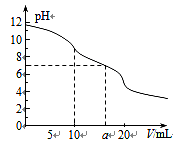
| A.当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
常温下,CaSO4的沉淀溶解平衡曲线如图,Ksp(CaSO4)=9×10-6。下列判断错误的是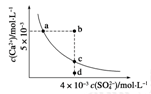
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp等于c点对应的Ksp |
| C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol·L-1 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是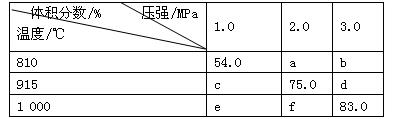
| A.a<54.0 |
| B.b> f |
| C.915 ℃,2.0 MPa时E的转化率为60% |
| D.K(1000 ℃)>K(810 ℃) |
下列实验现象与结论不一致的是
| 实验操作(或设计) |
实验现象 |
结论 |
|
| A |
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 |
HA放出的氢气多且反应速率快 |
酸性:HB > HA |
| B |
以镁、铝、氢氧化钠溶液构成原电池 |
镁表面有气泡 |
镁作原电池的负极 |
| C |
相同温度下,等质量的大理石与等体积等浓度的盐酸反应 |
粉状大理石产生气泡更快 |
反应速率: 粉状大理石>块状大理石 |
| D |
向盛有10滴0.1 mol·L-1 AgNO3溶液的试管中滴加0.1 mol·L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol·L-1 NaI溶液 |
先有白色沉淀,后转成黄色沉淀 |
Ksp(AgCl )> Ksp(AgI) |
下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是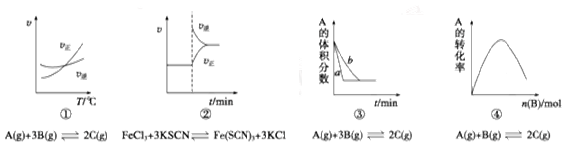
| A.①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像 |