往密闭容器中通入一定量N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,气体颜色变深。下图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律。X、Y分别是
2NO2(g),随温度升高,气体颜色变深。下图表示该反应平衡时有关物理量Y随某条件X(其他条件不变)变化的规律。X、Y分别是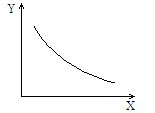
| A.温度T,逆反应速率υ逆 |
| B.温度T,气体的密度ρ |
| C.压强P,平衡常数K |
| D.压强P,N2O4转化率α |
某气体的水溶液呈酸性,该气体能使酸性高锰酸钾溶液褪色,也能使溴水褪色并出现浑浊,该气体是()
| A.HBr | B.SO2 | C.H2S | D.CO2 |
下列措施不合理的是()
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
下列各组离子一定能大量共存的是()
| A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ |
| B.在强碱溶液中:Na+、K+、CO32-、NO3- |
| C.在pH=12的溶液中:NH4+、Na+、SO42-、Cl- |
| D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO3- |
熔融烧碱应选用的器皿是()
| A.石英坩埚 | B.普通玻璃坩埚 | C.生铁坩埚 | D.陶瓷坩埚 |
下列叙述正确的是()
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.CO2、HCl、NH3的水溶液都能导电,它们均属于电解质