(14分)某化学小组拟利用下列流程测定某草酸亚铁样品(含有少量草酸,不含结晶水和其他杂质)中FeC2O4的含量。
已知几种氢氧化物开始沉淀和完全沉淀的pH如下表所示
| |
Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
试回答下列问题:
(1)用2 mol/L H2SO4溶液溶解草酸亚铁样品而不用蒸馏水直接溶解的原因是 ,加热至70℃左右,立即用KMnO4溶液滴定至终点。发生反应的离子方程式为2MnO4-+ 5H2C2O4+6H+ =2Mn2++ 10CO2↑+ 8H2O和 。
(2)保温放置30min的目的是 。
(3)证明反应Ⅰ完全的实验操作或现象为 。
(4)已知常温下Fe(OH)3的Ksp=1.1×10-36,废液中c(Fe3+)= mol·L-1。
(5)灼烧充分的标志是 。
(6)样品中FeC2O4的含量为 。
工业上采用硫化钠-石灰铁盐法处理高砷废水(砷的主要存在形式为H3AsO3)取得了很好的效果。实现了废水处理过程的“三废”零排放。其主要工艺流程如下: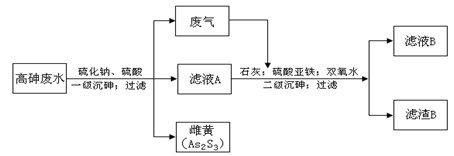
已知:①亚砷酸(H3AsO3)还原性较强,易被氧化为砷酸(H3AsO4)
②亚砷酸盐的溶解性大于相应的砷酸盐[如Ksp(FeAsO3)>Ksp(FeAsO4)]
请回答以下问题:
(1)废气的主要成分为,通过与石灰发生反应(填基本反应 类型)被吸收。
类型)被吸收。
(2)写出一级沉砷过程中生成雌黄的离子方程式:。
(3)滤液A中,除了有Na2SO4、H2SO4以外,还有溶质。
(4)二级沉砷过程中使用双氧水的目的有。
A.将三价砷氧化为五价砷,以提高除砷效果
B.将Fe2+氧化可生成Fe(OH) 3沉淀,以加速悬浮物的沉降
C.作绿色氧化剂,不引进新的杂质
(5)过滤操作常用的玻璃仪器有:
(6)滤渣B的主要成分有(写两种,用化学式表示)。
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略) (1)该装置设计上存在明显缺陷,其缺陷是__________
(1)该装置设计上存在明显缺陷,其缺陷是__________ __________________________。
__________________________。 (2)装置甲中反应的化学方程式是______________。
(2)装置甲中反应的化学方程式是______________。 (3)装置乙中的试剂是_____________________________________________________。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质 (4)请你帮助张明同学完成如下实验方案:
(4)请你帮助张明同学完成如下实验方案:
| 实验操作 |
预期现象和结论 |
 |
[实验三]用KHSO4制取H2O2并测其质量分数 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑) ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化; ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定; ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。 请回答:
请回答: (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是________________。 (7)原H2O2溶液中溶质的质量分数是___________________。
(7)原H2O2溶液中溶质的质量分数是___________________。
过氧化氢(H2O2)俗称双氧水,不稳定,易分解。溶液的酸碱性对H2O2的稳定性有较大影响,如在碱性溶液中,H2O2分解较快。另外,H2O2见光、遇热、遇到大多数金属氧化物分解也会加快。以下装置可用于探究H2O2相关的性质。
请回答:
(1)实验室用MnO2作催化剂分解H2O2制取氧气,反应的化学方程式为。
使用图1装置时,H2O2应该盛放在(填“锥形瓶”或“分液漏斗”)中,读取氧气体积时要注意。
(2)取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
①实验1、2研究的是对H2O2分解速率的影响。
②实验2、3的目的是。
(3)用(填“酸式”或“碱式”)滴定管量取25.00mL H2O2溶液于图II的烧瓶中,滴入过量KMnO4酸性溶液反应,最终收集到56mLO2(已折算为标准状况),则该H2O2溶液的物质的量浓度为。
(已知:2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)你认为测得的数值比理论值
(填“偏高”、“偏低”或“相等”)
(4)实验表明Na2O2与水反应也可生成O2。某同学猜想是Na2O2先与H2O反应生成H2O2,然后H2O2分解产生O2。为此做探究如下:取Na2O2样品(杂质不参与反应)与过量水充分反应的少量X溶液于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,该反应的离子方程式是。
乙醇在实验中用途广泛。
(1)下图为实验室用乙醇制取乙烯并与溴水作用制取1,2—二溴乙烷的部分装置图,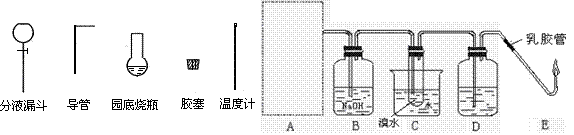
①请选用左图实验仪 器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。
器示意图在方框内画出乙烯的发生装置(夹持装置不必画出,需要加热的仪器下方用△标出)。
②B和D装置都盛有NaOH溶液,它们的作用是:B ____ __、D_________________。
③试写出以乙醇、浓硫酸、溴水为主要原料制取1,2—二溴乙烷的主要化学反应方程式。
_________________________________________________
_________________________________________________
④实验室用E图装置点燃乙烯,燃烧时 会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是:。
会产生黑烟,实验时若要迅速熄灭火焰,最简单、安全的操作方法是:。
(2)实验室可用C2H518OH和乙酸按图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)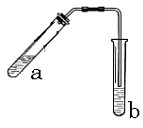
请填空:
①写 出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)
出实验室制乙酸乙酯的化学方程式(要标出氧-18示踪原子)
_______________________________________________________
②实验中加热试管的目的是:
③试管b中加有饱和Na2CO3溶液,其作用是
④反应结束后,振荡试管b静置,观察到的现象是
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分: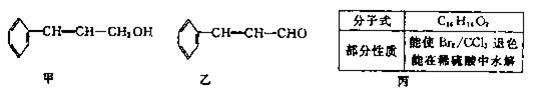
(1)甲、乙中含氧官能团的名称分别为、。
(2)经下列过程甲可转化为乙: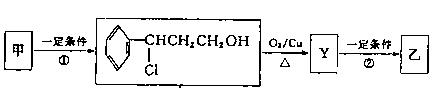
①,②的反应类型分别为、。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)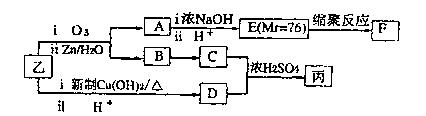
已知: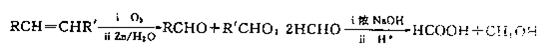
①F的结构简式为。
②由乙制取D的化学方程式为。
③写出同时符合下列要求的D的同分异构体的结构简式。
a.化合物是二取代苯
b.分子中有5种不同环境的氢原子,其个数比为l:2:2:1:2
c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应
④丙的结构简式为。