一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是: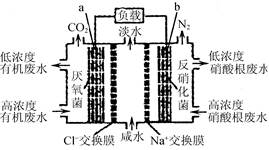
| A.b电极上发生氧化反应 |
| B.b电极附近溶液的pH增大 |
| C.a电极反应式:C6H10O5+24e-+7H2O===6CO2↑+24H+ |
| D.中间室:Na+移向左室,Cl-移向右室 |
下列离子方程式书写正确的是
| A.强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: 3ClO-+2Fe(OH)3 ="2" FeO42-+3Cl-+H2O+4H+ |
| B.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O |
| C.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-===BaSO4↓+H2O |
| D.把少量磷酸二氢钠溶液加入到氢氧化钡溶液中: |
2H2PO4-+3Ba2++4OH-=Ba3(PO4)3↓+4H2O
海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),下列有关说法正确的是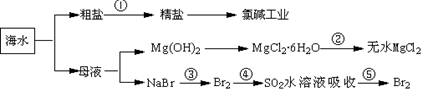
| A.大量的氮、磷废水排入海洋,易引发赤潮 |
| B.第②步中结晶出的MgCl2·6H20可在空气中受热分解制无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: |
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
在下列溶液中,各组离子可能大量共存的是
| A.PH>7的溶液中:Na+、Cl-、Ba2、Fe3+ |
| B.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| C.碳酸氢钠溶液中:K+、ClO-、Cl-、OH- |
| D.由水电离的c(H+)=10—13 mol·L—1的溶液中:Al3+、K+、NO3—、SO42— |
下列事实中,能说明氯的非金属性比硫强的是①HClO的氧化性比H2SO4的氧化性强②常温下氯气是气态而硫是固态③盐酸酸性比氢硫酸强④HCl比H2S稳定⑤H2S能被Cl2氧化成硫⑥HClO4酸性比H2SO4强⑦氯气与氢气化合比硫与氢气化合要容易进行⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.①②③④⑤⑥⑦⑧ | B.①④⑤⑥⑦ |
| C.④⑤⑥⑦⑧ | D.③④⑤⑦⑧ |
在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是
A.分散质微粒的大小与分散系种类的关系: |
B.常温下溶液的pH其酸碱性的关系: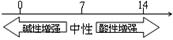 |
C.硫的化合物中化合价与其氧化性、还原性的关系: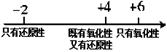 |
D.Fe在Cl2中燃烧的产物与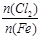 的关系: 的关系: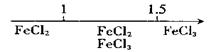 |