I.NH3在工业生产上有重要的应用
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式 ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式
II.某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去。为研究其组成,某小组同学进行了如下实验。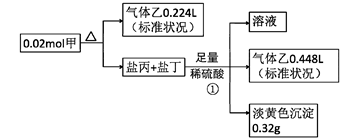
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图 ,甲的化学式
(2)写出①中产生黄色沉淀的反应的离子反应方程式
(3)乙能使品红溶液褪色的原因是
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式
(5)下列物质中可能在溶液中与甲反应的是
| A.NaI | B.Cl2 | C.AgNO3 | D.NaOH |
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,请按要求回答下列问题。
(1)金属A元素在周期表的位置是 ,G的化学式是__________。
(2)写出反应“C→F”的离子方程式 ;
(3)写出反应“I→J”的离子方程式 ;
(4)写出金属H与水蒸气在高温下反应的化学方程式 。
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):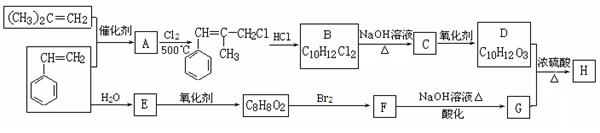
已知:
①B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
②
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2: 。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出生成F与足量氢氧化钠溶液在加热条件下反应的化学方程式: 。
(5)写出E在铜催化下与O2反应生成物的结构简式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构),其中核磁共振氢谱为5组峰的为 (写结构简式)。
(13分)下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题
(1)表中某元素最高正价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是______,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是_______(用离子符号表示,下同)。②、④、⑤元素的氢化物的沸点由高到低的顺序是____________。
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该离子反应方程是________________。
(3)由表中四种元素形成X、Y、Z、M、N等常见物质,X、Y含有一种相同元素,其中X焰色反应呈黄色,可发生以下反应:
①X、Y与水混合后反应的离子方程式为________________。
②N→⑦的单质反应的化学方程式为_________________。
③若将Y溶液加热蒸干、灼烧后得到的物质的化学式是________________。
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:________________。
②当C是一种产生温室效应的气体分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为_________;D中所含化学键的类型______________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的式量相等。
①用离子方程式表示F的水溶液呈酸性的原因__________________。
②A可由对应的单质直接化合生成,生成39gA时,放出255.5kJ的热量,写出该反应的热化学方程式_____________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的1/5 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:____;B转化为C的化学方程式为_______________。
[化学——选修5:有机化学基础]A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:
回答下列问题:
(1)A的名称是 ,B含有的官能团是 。
(2)①的反应类型是 ,⑦的反应类型是 。
(3)C和D的结构简式分别为 、 。
(4)异戊二烯分子中最多有 个原子共平面,顺式聚异戊二烯的结构简式为 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体 (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线 。