(10分)空气中氧气含量测定的再认识。
【实验回顾】图9是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
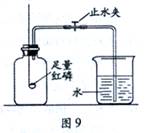
(1)写出红磷燃烧的化学方程式
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内
【问题提出】有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
【实验改进】
Ⅰ.根据铁在空气中生镑的原理设计图10实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
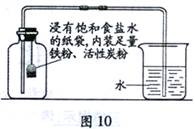
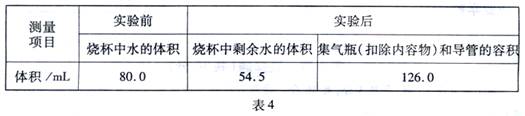
Ⅱ.测得实验数据如表4
【交流表达】
(1)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁
,写出该反应的化学方程式
(2)根据表4数据计算,改进实验后测得的空气中氧气的体积分数是
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是:
①
②
(1)用化学符号表示:
三个氢原子 ;两个氢分子 ;正一价的氢元素 .
(2)重水的主要用途是在核反应堆中作减速剂,一个重水分子(D2O)是由两个重氢原子(D)和一个氧原子构成.重氢原子的核电荷数为1,中子数为1,那么表示重氢原子结构的示意图是 (填下图序号).
重氢原子的相对原子质量为2,则重水的相对分子质量为 .
请根据下列装置图,回答有关问题:
(1)写出装置图中标号仪器的名称:a .
(2)写出实验室用大理石和稀盐酸反应制取二氧化碳可选用的收集装置是 (填字母).某同学用碳酸钠粉末和稀盐酸反应来制取二氧化碳,为了较好地控制反应速率,可选用的发生装置是 (填字母)
(3)你认为实验室制取气体时要注意的是: (填序号)
①选择适当的反应,包括 和 ;②选择合适的 ;③需验证所制得的气体.
如图是自然界碳的循环示意图,请据图分析后回答: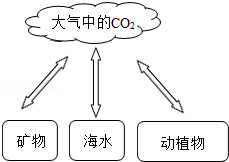
(1)自然界CO2的来源途径有 (任写一点);
(2)任何物质都有两面性,CO2对人类的正面影响是促进植物光合作用等,不利影响有 (任写一点);
(3)人类降低空气中CO2含量的研究有两个方向:一是减少CO2排放,二是增加CO2消耗,请写出一条你能做到的消耗CO2的方式或途径 .
生石灰作干燥剂的反应: ;它是 (选填“吸热”或“放热”)反应.
有浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是 ,反应的化学方程式为 ,因发生化学变化溶液质量增大的物质是 .