在浓硫酸的催化作用下,固体草酸(
)受热分解生成碳的氧化物和水。某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究:
【提出问题】生成物中有哪几种碳的氧化物?
【猜测】
| 猜想1 |
猜想2 |
猜想3 |
| 只有 | 只有 |
含有 和 |
【设计实验】基于猜想3,依据
和
的性质,兴趣小组同学设计了如下实验:

【实验探究】
(1)观察到
(2)有两种实验现象都能分别证明草酸分解的气体中含有
:
①
装置中澄清石灰水不变浑浊,
装置中
②
装置中出现
【实验结论】通过实验探究证明:猜测3成立。
草酸分解的化学方程式是
【问题讨论】
(1)
装置的作用是
(2)装置末端酒精灯的作用是
某化学活动小组在一次实验中进行了如图所示实验:
此时观察到的实验现象是(1)__________________________。
实验后,小组同学充分振荡U形玻璃管,将U形玻璃管内的物质过滤后,对滤液成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】滤液中除Na+外,还含有什么离子?
【猜想与假设】A同学:含有OH-、Cl-、C032-
B同学:含有OH-、Cl-、Ba2+
C同学:含有(2)__________________(填离子符号)
【实验探究】B同学为了验证自己的猜想,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此B同学得出结论:自己的猜想不成立,A同学的猜想成立。
【评价与交流】请你评价B同学的结论:(3)______________________。同学们经过讨论后一致认为:B同学在验证自己的猜想时,若将所加试剂调换成足量的另一种试剂(4)_____________(填化学式),既能验证自己的猜想.也能确定滤液中的离子成分。
C同学取该试剂进行实验,最终确定了滤渡中的离子成分。
【归纳与总结】通过上述实验我们能够总结出:在确定化学反应后所得溶液中的离子成分时,一般应加入(5)___________________,验证(6)____________________________就可以确定溶液中的离子成分。
某化学兴趣小组同学为了探究实验室中的氢氧化钠固体是否变质,进行了有关实验。请你与他们一起完成以下探究活动:
【猜想】
猜想I:没有变质;
猜想Ⅱ:已经变质;
【实验和推断】
(1)加入的适量 A 溶液是(填名称),若现象a为有气泡产生,则说明氢氧化钠已经变质。
(2)若现象b为,说明氢氧化钠没有变质。
【反思】氢氧化钠的保存方法是(填"A"或"B")。
A.密封保存 B.不需密封保存
操作和保存药品不当,标签常常易损毁。现有四瓶溶液①②③④的试剂标签已破损(如下图),但是已经知道这四瓶试剂是
、
、
、
溶液中的一种,某兴趣小组同学决定对四瓶破损标签溶液成分进行实验探究(实验另外药品只提供盐酸和酚酞溶液):
【提出问题】标签已经破损的①②③④四瓶溶液分别是什么溶液?
【实验探究1】第④瓶试剂肯定是:(写化学式)。
【实验探究2】兴趣小组对①②③④瓶溶液进行了如下的实验探究:
| 序号 |
实验步骤 |
实验现象 |
实验结论 |
| 1 |
取①②③瓶溶液少量 于三支试管中,分别 加入酚酞试液 |
酚酞试液不能将其中 的一种溶液鉴别出来 |
|
| 2 |
再取①②③瓶溶液少 量于另外三支试管中 分别加入溶液 |
加入了①溶液的试管 中; 其余两支试管中无明显现象 |
①瓶溶液为
|
| 3 |
取②③瓶溶液少量于 两支试管中,分别加 入溶液 |
加入了②溶液的试管 中; 加入了③溶液的试管 中; |
②瓶溶液为③瓶溶液为 |
【反思与交流】为了防止标签发生破损,我们在倾倒溶液时应注意:。
( 6分)氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A 、B 中,并进行了如下图所示的三组实验。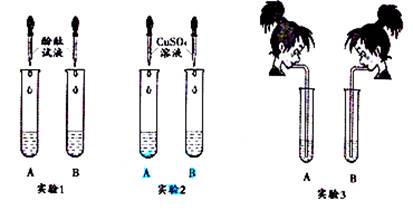
(1)实验l 中,两支试管的溶液都变成色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为,该反应的墓本类型是反应。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1 :溶质只有氢氧化钠
猜想2 :溶质只有碳酸钠
猜想3 :溶质有氢氧化钠和碳酸钠
……
实验和结论:
| 实验 |
实验现象 |
结论 |
| 取B 中少量溶液,加人澄清石灰水至不再 产生沉淀为止,过滤后取上层清液, 向其中加几滴酚酞试液。 |
产生白色沉淀 溶液呈现红色 |
猜想3成立 |
反思与评价:
老师评价李红得出的结论不正确,是因为猜想(填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将溶液换成溶液。
生石灰是一种传统的建筑材料,俗称"石灰"。工业上通过在石灰窑中煅烧石灰石制得"石灰",其反应原理是:
。兴趣小组的同学对某地刚出窑的"石灰"的成分进行探究。
【提出问题】刚出窑的"石灰"有那些成分?
【猜想】
I.只有氧化钙 II.只有碳酸钙 III.既有氧化钙也有碳酸钙
【实验探究】
(1)甲同学从样品中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,即猜想II成立。乙同学认为上述实验不足以证明猜想II成立,其理由是。
(2)乙同学从样品中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生。乙同学据此认为试管中的固体只有氧化钙,即猜想I成立。丙同学认为乙的实验不足以证明猜想I成立,理由是。
(3)丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和稀盐酸证明了猜想III成立,请完成他的实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
|
① ② |
猜想III成立 |
【思考】使用"石灰"的建筑工地上常有一个大的石灰池,使用"石灰"时,先将生石灰倒入池内水中,一段时间后,再取用其中的石灰浆使用。长期使用的石灰池内壁会逐渐增厚,其主要原因是
。