下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
C |
N |
O |
F |
Ne |
| 3 |
Na |
|
Al |
|
P |
S |
Cl |
|
(1)单质的化学性质最不活沷的元素是 ;
(2)氧的原子结构示意图是 ;
(3)形成化合物种类最多的元素是 ;
(4)HF和H2O中,热稳定性较强的是 ;
(5)N和P中,原子半径较小的是 ;
(6)常温下,会在浓硫酸中发生钝化的金属是 ;
(7)元素最高价氧化物对应水化物中,碱性最强的是 (填化学式),酸性最强的是 (填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 。
(1)向硫酸氢钠溶液中,逐滴加入Ba(OH)2溶液至中性。请写出发生反应的化学方程式:;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式;
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是,它的氧化产物是。
(3)此反应的离子反应方程式可表示为。
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出反应的离子方程式。
(1)FeSO4(CuSO4):
所需试剂(填化学式),所涉及的离子方程式:。
(2)O2(CO2):
所需试剂(填化学式),所涉及的离子方程式:。
(1)用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是。
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
(2)有一学生在实验室测某溶液的pH。实验时他先用蒸馏水湿润pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作(填“正确”或“不正确”),如不正确,请分析是否一定有误差 并说明理由(若正确则此问不用作答)
并说明理由(若正确则此问不用作答)
。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是,原因是。
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下: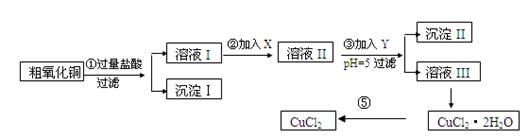
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 |
开始沉淀时pH |
完全沉淀时pH |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Cu(OH)2 |
5.2 |
6.4 |
表Ⅱ
| 氧化剂 |
调节pH的物质 |
||
| A |
双氧水 |
D |
氨水 |
| B |
高锰酸钾 |
E |
碱式碳酸铜 |
| C |
氯水 |
F |
氧化铜 |
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是。
(2)步骤②加入的试剂X可选用表Ⅱ中的(填序号),其作用是。
(3)步骤③加入的试剂Y可选用表Ⅱ中的(填序号),控制pH=5的目的是。
(4)步骤⑤要得到无水CuCl2,应控制的条件是。
(5)步骤①中所发生的全部反应的离子方程式:
。