现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
下列说法中正确的是
| A.所有主族元素的正化合价数,等于它的族序数 |
| B.第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C.第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D.前三周期元素中共有非金属元素12种 |
某元素的一个原子形成的离子可表示为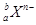 ,下列说法正确的是
,下列说法正确的是
A.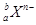 含有的中子数为a+b 含有的中子数为a+b |
B.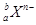 含有的电子数为a-n 含有的电子数为a-n |
| C.X原子的质量数为a+b+n | D.X原子的质量约为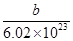 g g |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
| A.所用NaOH已吸潮 |
| B.向容量瓶加水时液面低于刻度线即摇匀 |
| C.有少量NaOH溶液残留在烧杯内 |
| D.向容量瓶加水时眼睛一直仰视液面 |
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁架、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗。只应用上述仪器或用品,不能进行的实验操作是
| A.蒸发 | B.萃取 | C.过滤 | D.蒸馏 |
对于相同物质的量的SO2和SO3,下列说法中正确的是
| A.硫元素的质量比为5∶4 | B.分子数之比为1∶1 |
| C.原子总数之比为4∶3 | D.质量之比为1∶1 |