下列热化学方程式书写正确的是(△H的绝对值均正确)
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=" —1367.0kJ/mol" (△H代表乙醇的燃烧热) |
| B.HCl (aq)+NaOH(aq)=NaCl(aq)+H2O(1) △H=—57.3kJ/mol(△H代表中和热) |
| C.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ/mol (反应热) |
| D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ/mol (反应热) |
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq) I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )
I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )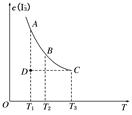
| A.该反应的正反应是吸热反应 | B.在反应进行到D点时,v正>v逆 |
| C.A点与C点的化学反应速率vA<vC | D.A点与B点相比,B点的c(I2)大 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
| A.a=3 | B.a=2 | C.B的转化率为40% | D.B的转化率为60% |
下列说法正确的是( )
| A.一定温度下,反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH>0、ΔS<0 |
B.水解反应NH+H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2===2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
如右图所示,在一U型管中装入含有紫色石蕊的 试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是( )
试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是( )
| A.蓝、紫、红 | B.红、蓝、紫 |
| C.红、紫、蓝 | D.紫、红、蓝 |
在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减少了 | D.a > b |