2L甲醛气体与xL的氧气混合点燃,甲醛充分反应后,生成的混合气体的体积为aL(气体体积均在120°C,101kPa时测定)。将aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL。若a-b=3.5,则x的值为
| A.2 | B.4 | C.1.75 | D.3.5 |
下列化学用语表达不正确的是 
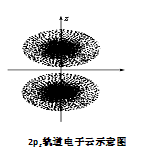
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
| A.2pz轨道上的电子在空间出现的概率分布是z轴对称 |
| B.点密集的地方表明电子出现的机会多 |
| C.电子先沿z轴正半轴运动,然后在负半轴运动 |
| D.2pz轨道形状为两个椭圆球 |
有下列两组命题 ,B组命题正确且能用A组命题加以正确解释的是()。
| A.Ⅰ① | B.Ⅱ② | C.Ⅲ③ | D.Ⅳ④ |
| A组 |
B组 |
| Ⅰ、H—I键键能大于H—Cl键键能 |
①HI比HCl稳定 |
| Ⅱ、H—I键键能小于H—Cl键键能 |
②HI沸点比HCl高 |
| Ⅲ、HI分子间作用力大于HCl分子间作用力 |
③HI沸点比HCl高 |
| Ⅳ、HI分子间作用力大于HCl分子间作用力 |
④HI沸点比HCl低 |
第四周期元素原子中未成对的电子数最多可达()。
| A.4个 | B.5个 | C.6个 | D.7个 |
下列说法中正确的是( )
| A.分子的形状BF3与BCl3全等 |
| B.分子的形状CHCl3与CH3Cl全等 |
| C.CCl4与C2H6分子中心原子原子轨道杂化的方式相同 |
| D.BF3与NF3分子中心原子原子轨道杂化的方式相同 |