一定温度下的恒容密闭容器中,可逆反应2NO2(g)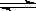 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
| A.②④⑥ | B.①④⑥ | C.②④⑤ | D.全部 |
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是
| A.PH3分子中有未成键的孤对电子 | B.PH3是非极性分子 |
| C.它的分子构型是平面三角形 | D.磷原子采用sp2杂化方式 |
下列粒子属等电子体的是
| A.NO和O2 | B.CH4和NH4+ | C.NH2¯和H2O2 | D.HCl和H2O |
既有离子键又有共价键和配位键的化合物是
| A.NH4NO3 | B.NaOH | C.H2SO4 | D.H2O |
下列物质中,难溶于CCl4的是
| A.碘单质 | B.水 | C.苯 | D.甲烷 |
用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |