下列有关说法正确的是
A.反应NH3(g)+HCl(g) NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0 NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0 |
| B.稀氨水中加入氢氧化化钠固体少量,由于氨水的电离平衡逆向移动,所以溶液的碱性减弱 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
D.CH3COOH溶液加水稀释后,溶液中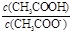 的值减小 的值减小 |
化学与科技、社会、生产、生活密切相关。下列有关说法正确的是
| A.氟利昂和NOX都能破坏臭氧层,从而导致“温室效应” |
| B.针对H 7 N 9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心 |
| C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| D.肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后不能全部都得到氨基酸 |
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是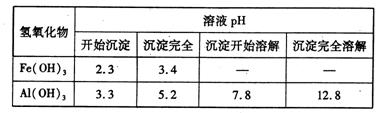
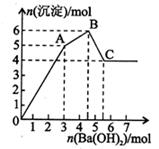
A.据图计算原溶液中c(Cl一)=c(SO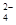 ) ) |
| B.OA段产生的沉淀为BaSO4和Fe(OH)3 |
C.AB段可能发生的反应是:2SO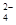 +2Ba2++ Al3+ +3OH-= 2BaSO4+Al(OH)3↓ +2Ba2++ Al3+ +3OH-= 2BaSO4+Al(OH)3↓ |
D.C点溶液呈碱性的原因是AlO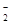 水解,其离子方程式为:AlO 水解,其离子方程式为:AlO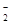 +2H2O=Al(OH)3 +OH一 +2H2O=Al(OH)3 +OH一 |
相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)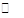 2SO3(g)△H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表: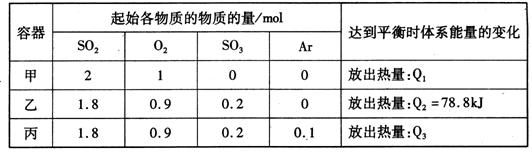
下列叙述正确的是
| A.Q1>Q3>Q2 =78.8kJ |
| B.三个容器中反应的平衡常数均为K=2 |
| C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% |
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=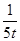 mol/(L·min) mol/(L·min) |
下列说法正确的是
A.能使pH试纸呈红色的溶液中可能大量存在以下离子:Na+、NH4+、I一、NO3-
B.将CH3COOH溶液和NaOH溶液等体积混合,该溶液中一定存在的关系式为:c(Na+)=c(CH3COO一)+c(CH3COOH)
C.pH=3的NaHA溶液中粒子浓度大小为:c( Na+)>c( HA一)>c(A2一)>c(H2A)>c(OH一)
D.CuSO4溶液遇到闪锌矿(ZnS)慢慢转化为铜蓝(CuS),是因为ZnS的溶解度大于CuS
下列有关实验操作设计、现象记录、结论解释都正确的是
| 实验操作设计 |
现象记录 |
结论解释 |
|
| A |
将少量浓硝酸逐滴加入Cu和稀硫酸的混合物中 |
产生红棕色气体 |
硝酸被还原为NO2 |
| B |
用坩埚钳夹住铝箔在酒精灯上加热 |
铝箔熔化但并不滴落 |
熔点:Al2 O3>Al |
| C |
向某氯化亚铁溶液中加入 Na2O2粉末 |
出现红褐色沉淀 |
加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D |
向紫色石蕊试液中持续长时间通人氯气 |
溶液先变红,最后变为无色 |
氯气有漂白性 |