恒温恒容时,向体积为2.0L密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/ mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)="0.0016" mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)="0.12" mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
镁-空气电池的工作原理如右图所示。下列说法不正确的是()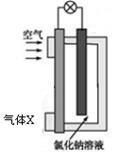
| A.工作一段时间后,c(Na+)变大 | B.电池工作时,OH-向a极移动 |
| C.气体X 中N2的百分含量与空气相同 | D.电池总反应为2Mg+O2+2H2O=2Mg(OH)2 |
下列说法正确的是()
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH=40.69 kJ·mol-1 H2O(l) 的ΔH=40.69 kJ·mol-1 |
| B.Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |
| C.已知: 共价键 C-C C=C C-H H-H 键能/ kJ·mol-1 348 610 413 436 则可以计算出反应 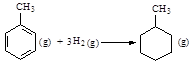 的ΔH为-384 kJ·mol-1 的ΔH为-384 kJ·mol-1 |
| D.固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O=NH3•H2O+H2↑ |
有关乙烯和苯分子中的化学键描述正确的是()
| A.苯分子中每个碳原子的sp2杂化轨道中的其中一个形成大π键 |
| B.乙烯分子C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| C.苯分子C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |
| D.乙烯和苯分子每个碳原子都以sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
| A.原子半径:W>Z>Y>X>M |
| B.1molWM溶于足量水中完全反应共转移2mol电子 |
| C.YZ2溶于水形成的溶液具有较强的氧化性 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体具有结构相似的特征,下列各对粒子中,空间结构相似的是()
①CS2与NO2②CO2与N2O③SO2与O3④PCl3与BF3
| A.①②③ | B.③④ | C.②③④ | D.②③ |