美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法正确的是
| A.a极为电池的负极,乙醇被还原 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:2H+ + O2 + 4e-= H2O |
| D.电池工作时1mol乙醇被氧化时,就有12mol质子 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.0.1molOH—含0.9NA电子 |
B.1.8g重水((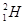 2O)中含NA个中子 2O)中含NA个中子 |
| C.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| D.标准状况下,11.2LH2O含有的分子数为0.5NA |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是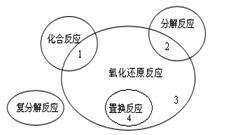
| A.Cl2+2KBr |
B.2NaHCO3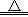 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O |
D.CH4+2O2 |
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系 的本质特征是分散质的微粒直径在10-9~10-7m之间 的本质特征是分散质的微粒直径在10-9~10-7m之间 |
| B.Fe(OH)3胶体能吸附水中悬浮的固体颗粒,而使之沉降,达到净水目的 |
| C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D.光线透过胶体时,胶体中可发生丁达尔效应 |
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的 性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是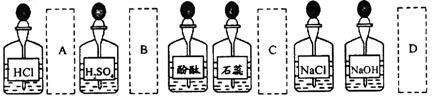
由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的是