短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是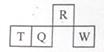
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.T的最高价氧化物对应水化物为强碱 |
已知,下列反应可以发生:Br2+H2SO3+H2O=2HBr+H2SO4,在100mL含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075mol/L | B.0.0018mol/L | C.0.075mol/L | D.0.08mol/L |
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
| A.KClO3在反应中失去电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被氧化 | D.1mol KClO3参加反应有2 mol电子转移 |
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的生成物是
| A.HI和HClO | B.HCl和HIO | C.HClO3和HIO | D.HClO和HIO |
设NA 代表阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol 硫酸钾中阴离子所带电荷数为NA |
| B.标准状况下,NA个SO3分子所占的体积约为22.4 L |
| C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+ |