牙膏摩擦剂的类型很多,如CaCO3,SiO2或它们的混合物。某兴趣小组对牙膏摩擦剂的成分进行了如下探究。
【提出问题1】某品牌牙膏中是否含有CaCO3?
【查阅资料】二氧化硅不与稀盐酸反应。
【实验方案】
①取少量牙膏于试管中,加入适量的稀盐酸,出现气泡,将气体通入澄清石灰水,石灰水变浑浊,证明摩擦剂中含有 (填离子符号)。
②取实验①中的溶液,加入碳酸钾溶液,生成白色沉淀,请写出该反应的化学方程式 。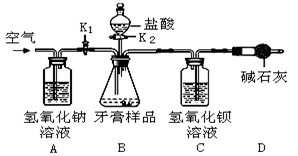
【提出问题2】该牙膏中CaCO3的质量分数是多少?
【实验装置】
【实验步骤】
(1)按如图连接好装置后,发现装置 (填字母)有一处明显的错误;
(2)重新连接好装置,并 ;
(3)在B装置中加入牙膏样品8.00g;
(4) K1, K2(填“打开”或“关闭”),向牙膏样品中滴入10%的盐酸,至 (填字母)中无气泡产生时,停止滴加盐酸;
(5)关闭K2,打开K1,缓缓 约8分钟;
(6)将C装置中的固液混合物过滤、洗涤、烘干后称量其质量。实验数据如图(已知此品牌牙膏中的其他成分不和盐酸反应,装置内试剂均足量)
【实验分析及数据处理】
(1)若没有A装置,直接通入空气,则测定结果将 (填“偏大”、“偏小”或“不变”)。
(2)D装置的作用是 。
(3)据上面数据,计算该牙膏样品中碳酸钙的质量分数是 。
(届上海市崇明县第一学期期末试题)已知草酸 (H2C2O4) 加热时在浓硫酸的催化作用下会发生分解反应,某化学兴趣小组对草酸分解的产物产生了兴趣,请你参与:
【提出猜想】甲:CO2 H2O乙: CO H2O
丙:NH3CO2 H2O丁: CO2 CO H2O
①某同学认为丙同学的猜想是错误的,理由是 (11)。
【查阅资料】氧化铁为红棕色粉末,一定温度CO能还原氧化铁;铁粉呈黑色。
【进行实验】为了验证上述猜想,将草酸在一定条件下分解的产物依次通过下列装置:
② A、B装置的顺序不能颠倒,原因是 (12)。
③实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红棕色粉末变成黑色,由此推断、(13)同学猜想成立。
④ D装置的作用是 (14),反应的化学方程式为 (15)。
【得出结论】⑤草酸分解的化学方程式为 (16)。
【反思与评价】⑥从环保角度考虑,上述实验的不足之处是 (17)。
如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示。
| 实验编号 |
容器I |
针筒I |
容器II |
针筒II |
红墨水液面位置 |
| a |
二氧化碳(充满) |
10mL澄清石灰水 |
二氧化碳(充满) |
10mL水 |
保持左高右低 |
| b |
0.55g锌 |
15mL盐酸 |
0.24g镁 |
15mL盐酸 |
(1)实验开始前红墨水左右两端液面保持相平。容器I、II体积相同,装置气密性良好。
(2)实验a中,容器I内产生的现象是_____________________________。红墨水液面位置发生变化的原因____________________________________________________________(用化学方程式表示)。
(3)实验b中,针筒I、II内盐酸足量且溶质质量分数相同,产生气泡更剧烈的容器是________(填“I”或“II”),(4)红墨水的位置变化情况是_____________________________________。
酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有 生成。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体。
以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
| 实验操作 |
测定结果 |
白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 |
pH>7 |
|
| CaCl2 |
实验反思:无明显现象的中和反应可借助酸碱指示剂判断反应终点。
(3)“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。
某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
| 部分物质的溶解性表(室温) |
||||
| OH- |
Cl- |
SO |
CO |
|
| H+ |
溶、挥 |
溶 |
溶、挥 |
|
| Ba2+ |
溶 |
溶 |
不溶 |
不溶 |
| Ca2+ |
微溶 |
溶 |
微溶 |
不溶 |
| Mg2+ |
不溶 |
溶 |
溶 |
微溶 |
①溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
②加入Na2CO3溶液的目的是什么?
③以上方案还需完善,请说明原因并加以补充。
(4)LiOH和NaOH的化学性质相似。“神舟”飞船内,可用盛有LiOH的过滤网吸收航天员呼出的气体,以降低CO2含量。请计算:用LiOH完全吸收176 g CO2生成Li2CO3和H2O,理论上至少需要LiOH的质量是多少?
(届北京市海淀区第一学期期末)某同学欲探究市售 “双钙防蛀”牙膏、“皓清”牙膏和牙粉的主要成分。

【查阅资料】
(1)牙膏和牙粉均是由摩擦剂、活性剂、香料等成分构成。
(2)常用的摩擦剂有极细颗粒的碳酸钙(CaCO3) 和水合硅酸(SiO2·nH2O)等
(3)牙膏和牙粉中除了碳酸钙以外,其它物质均不与稀盐酸反应产生气体。
【实验一】探究“两种牙膏和牙粉中是否都含有碳酸钙?
| 步骤 |
实验操作 |
实验现象 |
| ① |
 如图所示,取三只试管分别加入适量待测样品,再分别加入适量R 溶液。R 溶液是。 |
A试管中无明显变化, B和C试管中有无色气体生成。 |
| ② |
将B和C试管中生成的无色气体通入澄清石灰水。 |
现象Ⅱ:。 |
实验结论:。
【实验二】比较样品中碳酸钙的含量
| 步骤 |
实验操作 |
实验现象 |
| ① |
组装两套右图装置进行实验。分别取 (操作Ⅰ),放于锥形瓶中。并在分液漏斗中分别加入等质量的R 溶液。 |
|
| ② |
打开分液漏斗注入一定量R 溶液,然后关闭活塞。 |
有气泡产生。 |
| ③ |
待②反应结束后,再打开分液漏斗,注入一定量R 溶液,然后关闭活塞。 |
无明显现象 |
| ④ |
称量反应后装置及药品的总质量并加以比较 |
加入“双钙防蛀”牙膏的装置及药品的总质量大于加入牙粉的装置及药品的总质量 |
实验结论:_____________________________________________________;
步骤③的作用是:。
【反思】
(1)若不改动原有装置和基本步骤,要测定牙粉中碳酸钙的质量分数,还应测定的数据有:______;
(2)小明认为该实验前不需要测定装置的气密性,请你说明其原因。
某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图 1所示。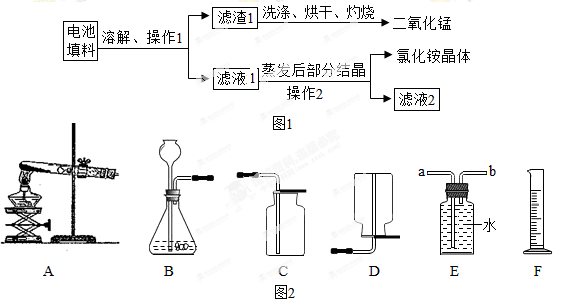
(1)操作1 和操作2 的名称都是____________,该操作中玻璃棒的作用是____________。
(2)灼烧滤渣 l 的目的是________________________ 。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图2。
①应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
②若用排水法收集并测定气体的体积,气体从装置B导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。
(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
| 验实号编 |
试剂 |
前10 min内产生的氢气体积(mL) |
|
| 不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
| a |
纯锌 |
30 mL 30 % |
564.3 |
| b |
含杂质的锌 |
30 InL 30 % |
634.7 |
| c |
纯锌 |
30 mL 20 % |
449.3 |
| d |
纯锌 |
40 mL 30 % |
602.8 |
①比较实验 a 和实验 b ,可以得到的结论是________________________。
②为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。