(1)在H、C、O、Ca四种元素中,选择适当的元素组成符合下列要求的物质。(填写化学式)
①沼气的主要成分 ,
②最常见的溶剂
③可被人体直接吸收的糖 ,
④常用的食品干燥剂
(2)水和空气是人类赖以生存的自然资源。
①下列有关水和空气的叙述中正确的是
A.人们饮用的纯净水中不含任何化学物质
B.水是生命之源,保护水资源包括防止水体污染和节约用水两方面
C.目前计入空气质量日报的主要污染物中已包括了二氧化碳
D.充分利用太阳能、氢能等清洁能源可减少酸雨、温室效应等环境问题的发生
②铁制品在空气中易锈蚀,其实质是铁与空气中的 等接触后发生了化学反应。
③溶解了较多的可溶性钙和镁的化合物的水属于硬水,生活中一般可用 的方法来降低水的硬度。
④实验室欲将50g质量分数为6%的氯化钠溶液稀释为3%的稀溶液,需加水的体积为 _mL。
用化学符号表示:
(1)水银 。
(2)2个钠离子 。
(3)人体缺少 元素会导致甲状腺疾病。
(4)最常用的溶剂 。
实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 (4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)

以MnO2为原料制备MnSO4•H2O的工业流程如图。
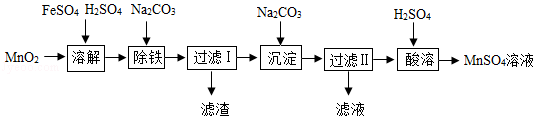
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑
②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。
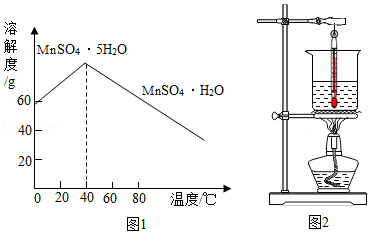
③MnSO4的溶解度曲线如图1所示。
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、 、 。水浴加热的优点有 。能加快溶解的方法有 (写一种)。
(2)除铁时需要搅拌,搅拌的作用是 。
(3)过滤I所得滤液的溶质主要是Na2SO4和 。过滤时,玻璃棒的作用是 。
(4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为 。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中, ,在高于40℃时趁热过滤, ,100℃烘干得MnSO4•H2O。
MgO在医药建筑等行业应用广泛。硫酸镁和木炭高温煅烧的产物为MgO(固体)、SO2、CO2、CO、硫蒸气。
(1)工业上,SO2的任意排放会引起的环境问题是 。化石燃料燃烧是产生SO2的主要原因,下列做法能减少SO2排放的是 (填字母)。
a.开发新能源替代化石燃料 b.向高空排放SO2
(2)在高温、催化剂条件下,CO和H2可化合成燃料甲醇(CH3OH),该反应中CO和H2的分子个数比为 。若CO和H2中混有H2S气体,H2S会与催化剂中的Cu在高温下发生置换反应,其中一种产物为CuS,该反应的化学方程式为 。
(3)利用如图装置对硫酸镁和木炭进行高温煅烧,并对产生的四种气体进行分步吸收或收集。
已知:常温下,硫为固体;SO2、CO2均能与NaOH溶液反应。
①装置B、C中的溶液分别是 、 。(填字母)
a.NaOH溶液
b.KMnO4溶液
②装置B、C的作用分别是 、 。
③装置D的作用是 。
④若将装置A中的固体隔绝空气加热至500℃,就会变成蒸气,其中有一种相对分子质量为128的气体。该气体的化学式为 。
日常生活、社会发展都与化学密切相关。
(1)3D打印机根据不同需求,使用不同材料,如铝合金、聚乙烯、碳纤维增强复合材料。其中属于无机材料的是 ,属于合成材料的是 ,属于复合材料的是 。
(2)《本草纲目》记载,杨桃具有去风热、生津止渴等功效。
①杨桃的主要成分是水,还含有糖类和蛋白质等。葡萄糖和蛋白质中属于有机高分子化合物的是 ,能在人体内分解生成氨基酸的是 。葡萄糖由 三种元素组成。
②经测定酸杨桃的pH为1.35,甜杨桃的pH为1.81,其中酸性较强的是 。(填“酸杨桃”或“甜杨桃”)
③酸杨桃中矿质元素含量如表2.人体缺少 元素易得佝偻病,缺少 元素易得贫血症。如表所列元素中,属于微量元素的是 、 。
表:每克酸杨桃中矿质元素的含量
|
矿质元素 |
K |
Ca |
Zn |
Fe |
|
含量/mg |
0.389 |
0.587 |
0.049 |
0.070 |
