(共7分)为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验。实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量。按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气。一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量。(提示:氢氧化钠和氯化钙固体即可以吸收水分也可以出去二氧化碳)实验数据如下表。
| |
蜡烛 |
装置Ⅱ |
装置Ⅲ |
| 反应前的质量/g |
15.8 |
182.3 |
212.2 |
| 反应后的质量/g |
14.4 |
184.1 |
216.6 |
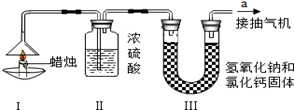
(1)该实验中测得水的质量为_______g,二氧化碳的质量为________g。
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为_____________。
(3)装置Ⅲ发生反应的化学方程式 。
(4)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是__________________。
(5)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?_______(填“能”或“不能”),理由是 。
按照一定依据把物质进行分类,是研究物质的组成、结构、性质、用途的常用方法。现有三组物质:①水、氧化铜、熟石灰、干冰;②空气、糖水、一氧化碳、不锈钢;③酒精、蛋白质、硫酸、甲烷。 按物质组成不同进行分类,每组中均有一种物质所属类别与其他三种不同,这三种物质依次是、、。
化学就在我们身边,它与我们生产、生活息息相关。现有以下常见的物质:
①CO2 ②CH3COOH ③NaOH ④KNO3 ⑤C2H5OH ⑥SO2
请选择合适物质的序号填空:
(1)绿色植物进行光合作用需要;
(2)属于复合肥的是;
(3)食醋中含有 ;
(4)国酒茅台中含有 。
右图中
、
分别是某微粒的结构示意图,回答下列问题: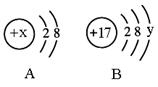
(1)若
表示某稀有气体元素的原子,则该元素的单质的化学式为。
(2)若
表示某元素的原子,则
,该元素的原子在化学反应中容易(填"失去"或"得到")电子。
(3)若
是阳离子的结构示意图,则
可能是下列中的(填字母序号)。
a.8 b.10 c. 11 d.12
(4)若
中
,则
、
所表示的元素形成化合物的名称为。
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25
时,将25
甲固体加入到50
水中,充分溶解并恢复到原温度后,得到溶液的质量为
。
(2)要使35
时接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是。
(3)现有操作步骤:
a.溶解 b.过滤 c.降温结晶 d.加热浓缩;
若甲固体中含有少量乙,则提纯甲的操作步骤是(填字母序号)。
(4)将35
时丙的饱和溶液降温到25
,则其溶液的溶质质量分数(填"变大"、"变小"或"不变")。
(5)向100
35
的水中加入45
甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。你认为"全部溶解"的原因可能是。
用化学方程式描述下列事实:
(1)常温下,铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是;
(2)氢氧化钙、黏土和沙子掺水混合而成的建筑材料俗称"三合土",在空气中会生成碳酸钙而变得坚硬,反应的化学方程式是;
(3)高温条件下一氧化碳能把铁从磁铁矿石(主要成分为
)中还原出来,反应的化学方程式.