K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
【相关资料】(1)含水结晶盐受热时通常先失去结晶水;
(2)图2中物质B就是工业产品Mn3O4 ;
(3)Mn3O4在高温时会被氧化,且锰的化合价从+1到+7变化时逐级升高,如+2的锰先氧化到+3的锰,再从+3氧化到+4分别是对应的氧化物为三氧化二锰和二氧化锰。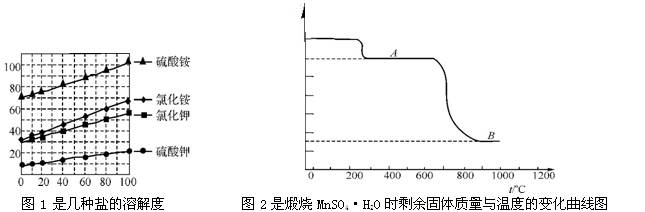
【问题解答】
(1)反应II中加入的NH4HCO3中氮元素的化合价为 ;
(2)反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、结晶、 、洗涤、干燥等操作即得K2SO4晶体;
(3)试分析反应Ⅲ后有K2SO4析出的原因是____________________________;
(4)加热MnSO4·H2O固体时第一次质量减少的原因是 (用化学方程式表示);
(5)煅烧过程中固体锰元素的质量分数随温度的升高而增大。但当温度超过1000℃时,再冷却后,测得产物中的锰元素的质量分数反而减小。试分析产物中锰元素的质量分数减小的原因: 。
下图是元素周期表的一部分,请根据表中提供的信息按要求填空:
| 3Li 锂 |
4Be 铍 |
5B 硼 |
① |
7N 氮 |
② |
9F 氟 |
10Ne 氖 |
| ③ |
12Mg 镁 |
④ |
14Si 硅 |
⑤ |
16S 硫 |
17Cl 氯 |
18Ar 氩 |
(1)由①②③三种元素组成的物质为。
(2)在元素周期表中,同一行元素最外层电子数的变化规是。
金属材料在生活、生产中应用十分广泛。
(1)图A是金属的一个应用实例,请说出利用了金属的什么物理性质?答出一点即可)。
(2)图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。该实验探究的目的是什么?
。
(3)若将一定量的铁粉投入到入一定量只含有Cu(NO3)2、AgNO3的工业废水中,充分反应后过滤,向所得滤渣中滴加稀盐酸,没有气泡产生,则滤渣中一定含有的金属是;一定不含有的金属是。
(4)非金属单质也具有类似金属与化合物溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其溶液中置换出来,如在溶液中可发生下列反应:
C12+2NaBr=2NaCl+Br2; Br2+2KI=2KBr+I2由此可判断:
①C12、I2、Br2活动性由强到弱顺序是。
②现有C12、I2、NaCl、KCl、NaI、KI六种物质,请选择适当物质写出一个符合上述规律的化学反应的方程式。
黑火药是我国四大发明之一,黑火药的爆炸可用以下式子表示其反应和生成物:2KNO3+3C+S K2S+N2+3X,则X的化学式为________,如果你配制火药,那么KNO3,C,S这三种原料的质量比是__________时,才能使火药燃烧最充分。
K2S+N2+3X,则X的化学式为________,如果你配制火药,那么KNO3,C,S这三种原料的质量比是__________时,才能使火药燃烧最充分。
有一种含有碎菜叶、碎塑料薄膜、泥沙、氯化钠,还具有一定臭味的生活污水,将其进行去渣、去臭处理后,可以转化为厕所冲洗用水。
(1)采用操作可以除去污水中的碎菜叶、碎塑料薄膜、泥沙等。
(2)用物质,可以除去污水中的臭味。
(3)把生活污水回收处理,进行再利用的目的是。
用化学符号填空:
(1)下面是四种粒子的结构示意图:
用字母序号填空:
①属于同种元素的是________________。
②表示阳离子的是__________________。
(2)用相应的化学用语回答:
①两个氢原子,②三个水分子,
③两个钠离子,④氧化铁的化学式,
⑤氧化镁中镁元素的化合价为+2价__ ____。