某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
下列有关推断合理的是
| A.根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B.沉淀H为Al(OH)3、BaCO3的混合物 |
| C.溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D.若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)="0.05" mol·L-1 |
已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.8×10-5 |
4.9×10-10 |
Ka1=4.3×10-7Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
为测定人体血液中Ca2+的含量,设计了如下方案:
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4K2SO4+2MnSO4+10CO2↑+8H2O
若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
| A.0.001mol·L-1 | B.0.0025mol·L-1 | C.0.0003mol·L-1 | D.0.0035mol·L-1 |
下列几种微粒中能影响水的电离平衡,且能使水的电离平衡向右移动的是
| A.HSO4- | B.Cl- | C.X+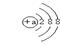 |
D.bX2-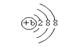 |
氮的单质有N2、N4(标准状况下是气体)、N30等,NA表示阿伏加德罗常数。下列说法正确的是
| A.N2、N4、N30是同分异构体 | B.相同质量的N2、N4、N30含有的分子数相同 |
| C.N2、N4、N30分子中的化学键只有共价键 | D.2.24L N2和1.12L N4中所含有的氮原子数都是0.2NA |
X、Y、Z、W为短周期主族元素,原子序数依次增大,X的族序数是周期数的2倍,Y的气态氢化物与最高价氧化物水化物可形成盐,Z的最外层电子数与其电子总数比为3:8,下列说法正确的是
| A.X、Y、W的最高价含氧酸酸性顺序:Y>W>X | B.气态氢化物的稳定性:Z>W |
| C.原子半径:Z>W>X>Y | D.X、W形成的化合物XW4属于离子化合物 |