氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) 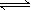 Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O 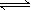 HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO 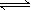 H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中,Cl2(aq)、HClO和ClO-分别在三者中所占的物质的量分数(α)随pH变化的关系如图所示。下列表述正确的是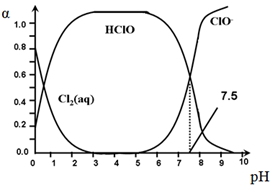
A.Cl2(g)+ H2O 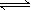 2H+ + ClO-+ Cl- ,K=10-10.9 2H+ + ClO-+ Cl- ,K=10-10.9 |
| B.pH=7.5时,用氯处理饮用水体系中,c(Cl-) + c(HClO) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的 
pH均为6的盐酸和NH4Cl溶液,其中水电离出的c(H+)值分别是x mol·L-1、y mol·L-1,两者的关系是()
| A.相等 | B.x>y | C.x=10-2y | D.x=102y |
关于热化学方程式:2H2(g)+O2(g)=2H2O(1),△ H=-571.6 kJ·mol-1,下列有关叙述不正确的()
H=-571.6 kJ·mol-1,下列有关叙述不正确的()
| A.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 |
| B.1mol H2完全燃烧生成液态水时放出285.8kJ的热 |
| C.2mol H2完全燃烧生成液态水时放出571.6 kJ的热 |
D.上述热化学方程式也可表示为H2(g)+ 1/2O2(g)=H2O(1), △H= -285.8 kJ·mol-1 -285.8 kJ·mol-1 |
在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应
A(s)+2B(g) C(g)+D(g)已达平衡的是 ( )
C(g)+D(g)已达平衡的是 ( )
A.混合气体的压强  |
B.混合气体的密度 |
| C.混合气体的相对分子质量 | D.C的物质的量 |
下列溶液中微粒浓度关系一定正确的是()
| A.室温时,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.室温时,pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |