完成下列小题(共14分)
(1)右图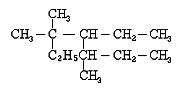 是某有机物结构简式,按系统命名法,该有机物的名称是 。
是某有机物结构简式,按系统命名法,该有机物的名称是 。
(2)主链含5个碳原子,有2个甲基作支链的烷烃有_______种。其中有一种同分异构体的分子,其一氯代物有4种同分异构体,写出其结构简式_____________,并对其命名____________。其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称______________。
(3)已知某有机物A在标况下的密度为1.34g/L,取A与氧气反应,得到等物质的量的CO2和H2O,则该有机物的分子式为______________。为测定A的结构,作核磁共振氢谱,发现只有一种吸收峰,则A可能的结构简式为____________。
(共13分)
(1)、物质的量浓度均为0.1 mol/L的下列溶液: ①KNO3、 ②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦NH4Cl,pH 由大到小的顺序为(填序号)
(2)、将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是________
(3)、下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K 2CO3溶液呈性;
Na2SO4溶液呈性;
CuCl2溶液呈性;
在一定条件下,可逆反应:mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关
系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
有机物A、B、C均由C、H、O三种元素组成。A中氧的质量分数为23.53%,且氢原子和碳原子数目相等,A的分子式的相对分子质量为最简式相对分子质量的2倍。在稀硫酸中加热A,可生成B和C,B、C均不与溴水反应,但B能与碳酸氢钠反应而C不能。试求:
(1)A的分子式;(2)A、B、C的结构简式。
在实验室里使稀盐酸与锌起反应,在标准状况时生成5.6 L氢气,计算(1)需要多少摩的锌?(2)需要2 mol / L 的盐酸多少mL ?