3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
已知:HCHO+CH3CHO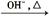 CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有 种。B中官能团的名称为 。
(2)试剂C可选用下列中的 。
a.溴水 b.银氨溶液
c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(3) 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 。
(4)E在一定条件下可以生成高聚物F,F的结构简式为 。
【化学—有机化学基础】PPMB(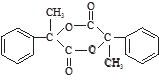 )是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如下:
)是一种重要的化工原料,在药物、新材料等方面有重要的应用,合成该有机物的一种路线如下:
已知:
(1)试剂X为____________________;E中含氧官能团名称为__________。
(2)遇氯化铁溶液显紫色且苯环上有两个取代基的D的同分异构体有________种。
(3)E在一定条件下可以生成高聚物F,F的结构简式为___________。
(4)PPMB与足量氢氧化钠的水溶液共热的化学方程式为__________________。
【化学——有机化学基础】吡氟氯禾灵是一种禾本科杂草除草剂,其选择性强、药效稳定、对人畜无毒,吡氟氯禾灵的一种合成路线如下: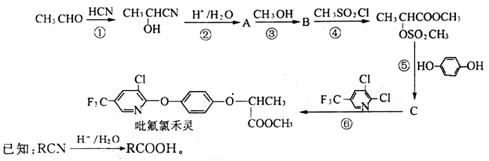
试回答下列问题:
(1)写出有机物A中含有的所有官能团的名称:____________________;
(2)在图示反应①~⑥中,属于加成反应的有________________(填反应的序号);
(3)有机物B的结构简式为____________________________________;
(4)1 mol有机物C与足量的NaOH溶液充分反应,最多可消耗______mol NaOH;
(5)写出反应⑥的化学方程式____________________________________________;
(6)同时满足下列两个条件的吡氟氯禾灵的同分异构体共有_________________种。
①含有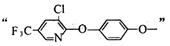
②能与碳酸氢钠溶液反应生成二氧化碳
【化学、选修5--有机化学基础】丙烯可用于合成很多有机物。下图是合成一种高性能的树脂单体的路线图,部分反应流程中的反应条件和少量副产物省略,请回答下列问题: 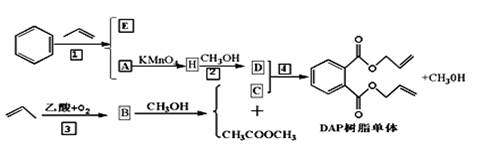
已知:①酯交换反应原理:RCOOR1+R2OH→RCOOR2+R1OH(R、R1、R2代表烃基)
②苯环与烯烃的加成反应原理如下: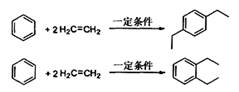
(1)H中含氧官能团的名称是,反应②的反应类型为。
(2)E为A的同分异构体,其两个相同的支链上核磁共振氢谱共有2个信号峰。写出E的结构简式。
(3)应用酯交换反应原理,写出反应④的化学方程式。
(4)D的同分异构体F苯环上只有两个相同的取代基,且能与NaOH溶液反应,F的结构共有种(不包括D)。
(5)H有一种同分异构体名称为对苯二甲酸,它与乙二醇发生缩聚反应可生成一种用途广泛的高分子材料(涤纶),其方程式为。
(6)以反应为起点,用丙烯为原料,其他无机试剂任选,写出制备甘油的最合理流程图,注明试剂和反应条件。注:合成路线的书写格式参照如下实例流程图: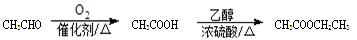
[化学---选修5:有机化学基础](15分)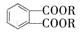 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97。工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97。工业上生产DMP的流程如图所示: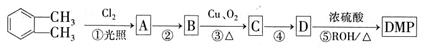
(1)上述转化中属于取代反应的是,D的核磁共振氢谱有组峰。
(2)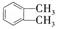 的名称,C中官能团的名称为,DMP的分子式为。
的名称,C中官能团的名称为,DMP的分子式为。
(3)A→B的化学方程式为。
(4)E是D的芳香族同分异构体,E具有如下特征:①遇FeCl3溶液显紫色;②能发生银镜反应;③苯环上有三个取代基,则符合条件的E最多有种,写出其中任意两种物质的结构简式为。
(5)用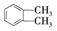 制备DMP的另一种途径:
制备DMP的另一种途径: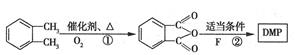
其中反应①还有另外一种产物,该产物最可能是,反应②中的另一产物是水,且n(F):n(H2O)=2:1,则F的结构简式为。
[化学一选修5:有机化学基础]某有机反应中间体(M)的一种合成路线如图所示。
③标准状况下,气态烃A的密度是H2的14倍
④芳香族化合物H能发生银镜反应
请回答:
(1)B的名称(系统命名)为________ ;H→I的反应类型为___________。
(2)E中官能团的结构简式为_________,
(3)F到G的化学方程式为________。
(4)D+J→M的化学方程式为_________。
(5)写出符合下列条件的J的所有同分异构体的结构简式________(不考虑立体异构)。
①苯环上连有-NO2
②核磁共振氢谱有3个峰
(6)结合已有知识和相关信息,写出以CH3CHO和E为原料,经三步制备
合成路线流程图示例为: