设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③将含0.1 mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
| A.①②③ | B.①②④ | C.①②③④ | D.②④ |
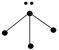
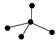
下列各图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子
后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是()
| A |
B |
C |
D |
 |
 |
 |
 |
| NH3 |
C2H4 |
CCl4 |
CO2 |
下列关于元素的叙述正确的是()
| A.金属元素与非金属元素能形成共价化合物 |
| B.只有在原子中,质子数才与核外电子数相等 |
| C.目前使用的元素周期表中,最长的周期含有36种元素 |
| D.由非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8 |
甲、乙、丙、丁四种物质均为只含两种元素的化合物,且均含18个电子。下列有关这
四种物质的推断,正确的是()
| A.可能在某种物质中含有离子键 |
| B.四种物质都是共价化合物 |
| C.四种物质都不可能具有强氧化性 |
| D.有一种物质是乙烷的同系物 |
下列过程中,共价键被破坏的是()
| A.碘升华 |
| B.二氧化氮被木炭吸附 |
| C.酒精溶于水 |
| D.HCl气体溶于水 |
下列有关化学用语的使用正确的是()
A.CH4分子的比例模型: |
B.NH3的电子式: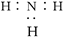 |
C.Cl-的结构示意图: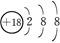 |
| D.CO2的结构式:O=C=O |