关于元素周期表和元素周期律的应用有如下叙述:
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料。
其中正确的是
| A.①②③④ | B.②③④ | C.③④ | D.②③ |
下列物质在光照条件下,可与C2H6发生化学反应的是
| A.Cl2 | B.O2 | C.溴水 | D.酸性KMnO4溶液 |
下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是
| A.乙烷与氯气混合 | B.乙烯与氯化氢气体混合 |
| C.乙烯与氯气混合 | D.乙烯通入浓盐酸 |
有机物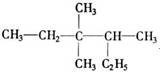 的正确命名为
的正确命名为
| A.2-乙基-3,3-二甲基-4-乙基戊烷 |
| B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基已烷 |
| D.2,3,3-三甲基已烷 |
下列叙述错误的是
| A.烷烃分子中的每个碳原子都和其它原子形成四个共价键 |
| B.凡是烷烃,不论碳链长短都可视为结构相似 |
| C.组成上相差一个或若干个CH2原子团的物质互为同系物 |
| D.互为同系物的物质具有相似的化学性质 |
不能使酸性KMnO4溶液褪色的是
| A.乙烯 | B.聚乙烯 | C.丙烯 | D.乙炔 |