分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是__________。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是__________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:_____________
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: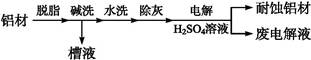
以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是
。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。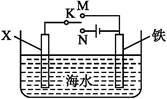
若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应,负极: ;正极: 。
(2)为了减小某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。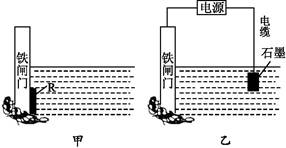
硒是制造光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如下: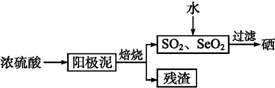
请回答下列问题:
(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称。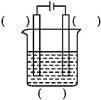
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se与浓硫酸反应的化学方程式为 。
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为 。
电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为 。
(4)上述硒的提取过程中存在的主要问题是 。
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾溶液反应的离子方程式是 。
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。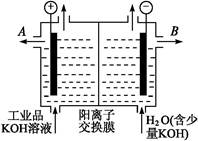
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③除去杂质后的氢氧化钾溶液从溶液出口 (填写“A”或“B”)导出。
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。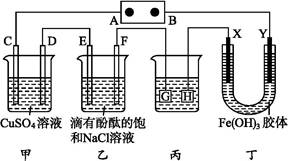
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“铜件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。