仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
若溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |
在25ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是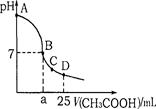
A.在A、B间任一点(不含A、B点),溶液中可能有C(Na+) > C(CH3COO-) > C(OH-) > C(H+)
B.在B点,a>12.5,且有C(Na+) = C(CH3COO-) = C(OH-) = C(H+)
C.在C点,C(CH3COO-) > C(Na+) > C(OH-) > C(H+)
D.在D点,C(CH3COO-) + C(CH3COOH) = C(Na+)
下列说法正确的是:
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1 |
| B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) =" C" (CH3COO-) |
| D.硫化钠溶液中,C (Na+) =" 2" C (S2-) |
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
图中,两电极上发生的电极反应为:a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+
下列说法中不正确的是
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |